Resumen
La terapia fibrinolítica intrapleural (IPFT), también conocida como terapia enzimática intrapleural (IET), se ha utilizado durante décadas para tratar infecciones pleurales al acelerar el drenaje en pacientes con organización pleural. El exitoso ensayo Mist2 demostró que IPFT mejora la opacificación pleural, reduce las estadías en el hospital y disminuye las referencias quirúrgicas a corto plazo. A pesar del progreso significativo, los brechas permanecen en la identificación de los agentes fibrinolíticos óptimos, la dosificación y las mejoras de seguridad. Generalmente se recomienda IPFT para pacientes con recipiente y drenaje pleural fallido, con un panel de consenso que defiende el activador de plasminógeno tisular combinado (TPA) y la terapia con DNasa. La forma en que cada agente puede afectar la actividad o función del otro en la combinación sigue sin estar claro. Si bien IPFT puede reducir la necesidad de intervención quirúrgica, hay relativamente pocos ensayos clínicos comparativos para guiar la terapia inicial. Los enfoques emergentes de tratamiento con dosis bajas de IPFT pueden beneficiar a los pacientes que son malos candidatos quirúrgicos. Los enfoques candidatos personalizados de IPFT, como el ensayo de potencial fibrinolítico (FPA), podrían refinar la dosificación y mejorar los resultados. Además, biomarcadores como el líquido pleural PAI-1 y las concentraciones de SUPAR pueden predecir los resultados clínicos y guiar el tratamiento. Los nuevos agentes terapéuticos, incluidos los péptidos inhibidores de PAI-1 y los objetivos profibrogénicos mesoteliales, están bajo investigación para mejorar la eficacia de IPFT. Estos avances son prometedores para mejorar la gestión de infecciones pleurales y otras formas de organización pleural.
Introducción
La terapia fibrinolítica intrapleural (IPFT), a veces ahora conocida como terapia enzimática intrapleural (IET), tenía su inicio para el tratamiento de la infección pleural hace décadas. Está diseñado para acelerar el drenaje en pacientes con una organización asociada con infecciones pleurales, así como aquellos con hemotórax retenido o un lugar de efusiones malignas (Fig. 1). El uso actual de IPFT para las infecciones pleurales estaba particularmente reforzado por el exitoso ensayo Mist2 que mostró una mejor opacificación pleural, una reducción de la estadía hospitalaria y una derivación quirúrgica reducida a corto plazo (1). La última vez que escribimos sobre este tema hace siete años en esta revista, momento en el que hubo varias incógnitas sobre cómo se debería usar IPFT y qué limitaciones existían. Las brechas clave incluían una falta de comprensión sobre qué agentes o combinaciones fibrinolíticas eran óptimas, la dosificación empírica de los agentes actualmente disponibles y si la efectividad y la seguridad podrían mejorarse mediante una mejor comprensión de estas áreas importantes. Se han hecho un progreso significativo en el ínterin, pero las brechas parcialmente abordadas permanecen. Su reconocimiento es un catalizador para esta actualización, que esperamos que pueda informar mejor las expectativas para los médicos que manejan las complejidades de tratar pacientes con ubicación y drenaje comprometido.
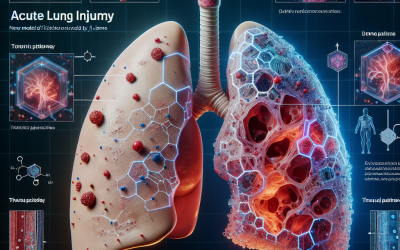
Fig. 1Degradación de la organización intrapleural por IPFT. IPFT (UPA o TPA ± DNasa) o UPA y TPA endógenos degradan la neomatrix fibrinosa extracelular transicional en el espacio pleural. La organización intrapleural puede acompañar a las infecciones intrapleurales, hemotoraces retenidas u organizar neoplasias pleurales. El proceso está regulado por mediadores, como TGFβ, factor de coagulación Xa y trombina, que promueven la elaboración de los componentes de Neomatriz por el mesotelio y las células de linaje alternativo (3). La organización pleural también implica la transición de células mesoteliales pleurales a miofibroblastos (Mesomt). La fibrinólisis se suprime mediante la regulación positiva de PAI-1 y la inhibición de la actividad del activador de plasminógeno endógeno o exógeno. Los miofibroblastos también contribuyen a la reorganización del espacio pleural al producir proteínas de matriz extracelular como colágeno y fibronectina en la superficie mesotelial y la membrana basal. Dirigirse a varios aspectos de esta transición puede ofrecer oportunidades terapéuticas para tratar el fibrotorax. Los objetivos potenciales incluyen la inhibición de las vías de señalización profibrogénica como GSK-3β y MTORC2, así como proteínas como Dock2 y miocardina (20). Además, la restauración de la fibrinólisis local mediante la administración de TPA intrapleural y UPA puede contrarrestar la inhibición mediada por PAI-1, bloquear una mayor deposición de fibrina y un lugar claro asociado con una organización intrapleural relativamente avanzada. Hilos verdes: fibrina, cepas rosadas: otras proteínas de matriz extracelular que incluyen fibronectina, hebras moradas: hilos de colágeno
Imagen de tamaño completoUso actual de IPFT
Ahora se aboga por IPFT en general para su uso en pacientes con recién nacido y drenaje pleural fallido, aunque algunos de los pacientes en Mist2, por ejemplo, tenían efusiones de flujo libre e infección pleural (1). Curiosamente, un panel de consenso estratificó el uso de IPFT para infecciones pleurales basadas en la utilización inicial en la colocación inicial del drenaje torácico en pacientes seleccionados y dependiendo de la disponibilidad de experiencia quirúrgica (2). Además, el panel recomendó activador de plasminógeno de tejido combinado (TPA) y terapia con DNasa administrada a una dosis de 10 y 5 mg respectivamente, dos veces al día; la misma dosificación utilizada en Mist2 (1). Se recomendó el uso de la administración concurrente de estos agentes, aunque se reconoció que los efectos de cualquiera de los agentes en el otro eran desconocidos. En otros centros, el uso de IPFT de agente único para infecciones pleurales ha sido y todavía se informa, como en el pasado (3, 4). Una dosis inicial de 5 mg de TPA con 5 mg de DNasa parece ser segura y efectiva (5, 6). La dosificación reducida del TPA en la combinación ahora se deriva de un número limitado de estudios de desescalación de dosis, como el ensayo informativo de adapt2. (6, 7) El sangrado sigue siendo una complicación con tales desescalaciones de dosis y los autores reconocen que se requieren pruebas de prueba adicionales de la dosis reducida TPA en la combinación de TPA/DNasa IPFT.
IPFT vs. Cirugía para Empyema
IPFT puede mitigar la necesidad de intervención quirúrgica en infecciones pleurales, aunque hay relativamente pocos estudios comparativos de los enfoques en la organización de la infección pleural, como se revisó recientemente. (2), Si bien el debate continúa sobre los roles de IPFT versus la cirugía para el manejo del empiema, la cirugía en el empiema en etapa temprana puede acortar la necesidad de acceso al tubo torácico y la duración del hospital de la estadía, en comparación con IPFT ((8). Sin embargo, es más invasivo, requiere un equipo quirúrgico capacitado, resulta en complicaciones de procedimiento frecuentes y tiene mortalidad. El estudio prospectivo Mist3 (9) compared patients who failed initial standard therapy with antibiotics or tube thoracostomy and concluded that while the standard treatment of patients with empyema may be less effective than early IPFT or VATS, there may have been a significant cohort (up to 50% of patients randomized to the VATS group), who did not appear to require surgical treatment (9). Una comparación piloto prospectiva reciente de la cirugía con Mist2 TPA/DNasa IPFT en pacientes con drenaje fallido en el tubo torácico demostró tendencias hacia el uso del tubo torácico más corto y la duración del hospital en el grupo quirúrgico (10). Mientras que se necesitan más ensayos clínicos prospectivos para comparar la eficacia de la cirugía temprana e IPFT/IET para los nuevos tratamientos de dosis bajas de IPFT/IET que emergen de estudios preclínicos (3) pueden beneficiar a los pacientes que malos candidatos quirúrgicos o que rechazan la cirugía.
Terapia de monoterapia versus combinación
Si TPA/DNasa IPFT afecta la actividad de cualquiera de los agentes sigue sin estar clara y podría probarse in vitro o en presencia de una variedad de fluidos pleurales de pacientes con infecciones pleurales, hemotórax retenido o derrame pleural maligno local, pero hasta donde sabemos, estos análisis aún no se han realizado. Mientras que la combinación actualmente disponible con TPA ofrece ventajas (1), la monoterapia con un agente fibrinolítico intrapleural parece ser segura y efectiva en las infecciones pleurales pediátricas, y la DNasa parecía ofrecer poca ventaja para el uso de un agente fibrinolítico en niños (11). Agente único; La IPFT de fibrinolisina también parece ser efectiva y segura cuando se administra en pacientes con hemotórax retenido (3, 4) y posiblemente organizando neoplasias pleurales con ubicación. Si la terapia de agente único podría ser beneficioso en subconjuntos de adultos con infecciones pleurales y drenaje pleural fallido tampoco está claro. En la actualidad, los ensayos de este tipo serían previsiblemente un desafío dadas las incertidumbres de la dosificación y el mejor momento de tales intervenciones.
A fin de cuentas, se ha recomendado el uso de TPA (10 mg) y DNasa (5 mg) (1, 2) y actualmente tiene la mejor base probatoria para su uso en pacientes adultos con infecciones pleurales. Es importante recordar que esta dosis fue seleccionada empíricamente en lugar de basarse en la respuesta preclínica de la dosis y los estudios de toxicología. Iban dosis de más; ¿12 o 15 mg de TPA, por ejemplo (o ligeramente menos), serán bien tolerados y más efectivos? ¿Es el horario de dosificación realmente óptimo o se puede modificar para ventaja mejores resultados clínicos? ¿La dosis del complemento DNasa es óptima o incluso se necesita si la dosis de TPA se optimizó? Estas consideraciones se derivan del uso no etiquetado de la combinación TPA/DNasa y permanecen por examinar en pacientes con infección pleural organización local y drenaje comprometido.
Las dosis más bajas de TPA pueden ser efectivas en la ubicación pleural infecciosa con drenaje fallido, pero se necesita más evidencia de ensayos clínicos. (7) Si dicha dosificación podría ser efectiva y mitigar el sangrado clínico podría probarse determinando la capacidad de las diferentes formas de IPFT para generar actividad fibrinolítica y activador de plasminógeno (PA) en fluidos pleurales de pacientes con empiema expuesto a los diferentes regímenes. Estos efectos se midieron en líquidos pleurales de pacientes que recibieron dosis crecientes de Urokinasa PA (SCUPA) de una sola cadena, un nuevo candidato para el tratamiento de infecciones pleurales loculadas con drenaje fallido (12). Scupa es relativamente resistente a la inactivación por …
(Tagstotranslate) Neumología/sistema respiratorio