Abstracto
Fondo
Se ha inferido que la presencia de un cortocircuito de circulación arterial pulmonar (SPS) sistémica durante el procedimiento de embolización arterial bronquial (BAE) es un factor de riesgo potencial para la recurrencia. El objetivo de este estudio es revelar el impacto de SPS en la recurrencia de hemoptisis no relacionada con el cáncer después de BAE.
Métodos
En este estudio, se compararon 134 pacientes con SPS (grupo presente de SPS) y 192 pacientes sin SPS (grupo ausente de SPS) que se sometieron a BAE por hemoptisis no relacionada con el cáncer desde enero de 2015 hasta diciembre de 2020. Se utilizaron cuatro modelos diferentes de regresión de riesgos proporcionales de Cox para aclarar el impacto de los SPS en la recurrencia de hemoptisis después de BAE.
Resultados
Durante la mediana de tiempo de seguimiento de 39,8 meses, se produjo recurrencia en 75 (23,0 %) pacientes, incluidos 51 (38,1 %) en el grupo con SPS presente y 24 (12,5 %) en el grupo sin SPS. Las tasas de supervivencia libre de hemoptisis a 1 mes, 1 año, 2 años, 3 años y 5 años en los grupos con SPS presente y sin SPS fueron 91,8 %, 79,7 %, 70,6 %, 62,3 % y 52,6 % y 97,9%, 94,7%, 89,0%, 87,1% y 82,3%, respectivamente (P < 0,001). Los cocientes de riesgos instantáneos ajustados de los SPS en los cuatro modelos fueron 3,37 [95% confidence intervals (CI), 2.07–5.47, P < 0.001 in model 1]1,96 (IC 95 %, 1,11–3,49, P = 0,021 en el modelo 2), 2,29 (IC 95 %, 1,34–3,92, P = 0,002 en el modelo 3) y 2,39 (IC 95 %, 1,44–3,97, P = 0,001 en el modelo 4).
Conclusiones
La presencia de SPS durante BAE aumenta la probabilidad de recurrencia de hemoptisis no relacionada con el cáncer después de BAE.
Introducción
La hemoptisis es un síntoma común de las enfermedades respiratorias y puede poner en peligro la vida debido al riesgo de asfixia y pérdida aguda de sangre. En las últimas décadas, la embolización arterial bronquial (EAB) ha sido reconocida como un método mínimamente invasivo y efectivo para el control de la hemoptisis. [1]. Sin embargo, la recurrencia de hemoptisis no relacionada con el cáncer después de BAE todavía es común. La tasa de recurrencia temprana (≤ 1 mes) se ha mantenido por debajo del 10 %, mientras que la tasa de recurrencia acumulada a largo plazo llega al 30 %. [2,3,4,5]. Entre los pacientes con recaída, 40 a 60% requieren embolización o lobectomía repetida o experimentan la muerte [3, 6, 7].
Los factores de riesgo definitivos para la recurrencia después de BAE incluyen fumar mucho, destrucción pulmonar, aspergilomas y vasos culpables de arterias sistémicas no bronquiales (NBSA) [3, 6,7,8]. Además, se ha inferido que otro parámetro específico de la arteriografía durante el procedimiento BAE, la presencia de derivación de circulación arterial pulmonar (SPS) sistémica, es un factor de riesgo potencial para la recurrencia, aunque esto sigue siendo controvertido. [2, 3, 6, 8,9,10,11]. Existe una red vascular entre los circuitos circulatorios sistémico y pulmonar tanto a nivel capilar como precapilar en condiciones fisiológicas y anatómicas naturales. [12]. La inflamación pulmonar de curso largo induce hipertrofia de los vasos sistémicos y luego amplifica estos vasos comunicantes como derivaciones sustitutas.
Estas derivaciones se abren patológicamente y son propensas a romperse bajo inflamación crónica y presión arterial sistémica. [13]. En este contexto, se aplica un SPS para la regulación hemodinámica como alteración compensatoria en ~30% de los pacientes con hemoptisis [14, 15]. Sin embargo, el efecto de los SPS ha recibido relativamente poca atención en estudios previos y algunos resultados han demostrado el valor predictivo negativo de los SPS para la recurrencia. [6, 11, 16]. Un estudio anterior reveló que la incidencia de recanalización del mismo vaso en pacientes con SPS (80,0 %) parecía ser mayor que en pacientes sin SPS (30,8 %). [3], que también puede proporcionar pistas sobre el mecanismo de recurrencia. Dados estos hallazgos, es necesario aclarar si la presencia de SPS durante BAE es un factor de riesgo independiente para la recurrencia después de la embolización y puede iniciar la exploración de estrategias de tratamiento adicionales. Presumimos que la presencia de derivación aumentaría la recurrencia de hemoptisis no relacionada con el cáncer después de BAE.
Por lo tanto, realizamos un estudio de cohorte retrospectivo para investigar la asociación entre la presencia de SPS y la recurrencia de hemoptisis no relacionada con el cáncer después del tratamiento endovascular.
Materiales y métodos
El protocolo de investigación de este estudio retrospectivo fue discutido y aprobado por la junta de revisión de ética institucional local, y se eliminó el requisito de consentimiento informado debido a su naturaleza retrospectiva. Todos los procedimientos realizados en este estudio se realizaron de acuerdo con los estándares éticos del comité de investigación institucional y/o nacional y con la Declaración de Helsinki de 1964 y sus enmiendas posteriores o estándares éticos comparables. Los datos analizados en este estudio están disponibles previa solicitud razonable del autor correspondiente.
Participantes del estudio
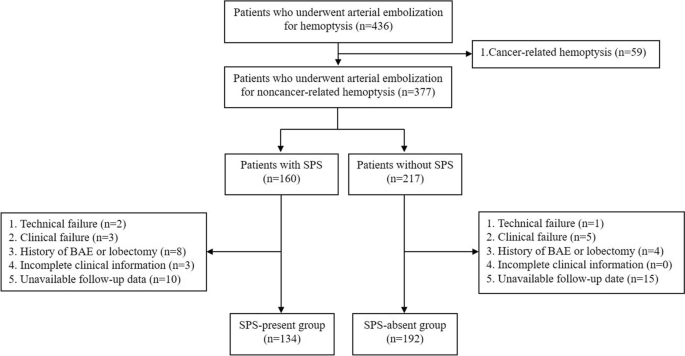
Consultamos la información basal, la tomografía computarizada (TC) preoperatoria y los datos angiográficos de 436 pacientes adultos consecutivos que se sometieron a embolización arterial por hemoptisis en nuestra institución entre enero de 2015 y diciembre de 2020. Los criterios de exclusión fueron los siguientes: (1) hemoptisis relacionada con el cáncer (n = 59); (2) falla técnica (n = 3); (3) fracaso clínico (n = 8); (4) antecedentes de BAE o lobectomía (n = 12); (5) información clínica incompleta (n = 3); y (6) fecha de seguimiento no disponible (n = 25). Finalmente, 134 pacientes se inscribieron en el grupo de presencia de SPS, mientras que 192 pacientes se inscribieron en el grupo de ausencia de SPS. Cifra 1 muestra el diagrama de flujo de inscripción del paciente. La presencia de SPS se identificó por la presencia de arterias de alimentación (arterias bronquiales y NBSA) y vasos comunicantes y de drenaje patológicos (Fig. 2) en angiografía dinámica por dos médicos de forma independiente; la decisión fue discutida con un médico senior y se llegó a un acuerdo, asegurando la confiabilidad de la evaluación.
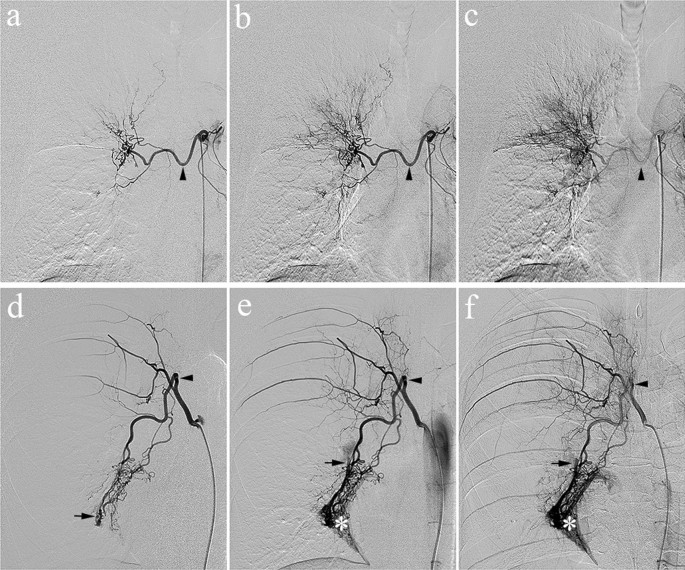
Imágenes representativas de pacientes con/sin derivación de la arteria bronquial-circulación pulmonar en la angiografía. Varón de 62 años con hemoptisis criptogénica (a–C). muy temprano (a), temprano (b), y tarde (C) fases arteriales en la angiografía de la arteria bronquial culpable (punta de flecha negra) sin la presencia de un shunt. Mujer de 31 años con bronquiectasias (d–F). La angiografía de la arteria bronquial culpable (punta de flecha negra) reveló que la derivación de circulación pulmonar-arteria bronquial (flecha negra) estaba opacificada en la fase arterial muy temprana (d), que permaneció opacificado en las fases arterial temprana y tardía acompañado de tinción del parénquima pulmonar(mi–F
imagen a tamaño completo
covariables [17]Las covariables en el presente estudio incluyeron información inicial (edad, sexo, enfermedad pulmonar subyacente, tabaquismo, hipertensión, duración y volumen de la hemoptisis), hallazgos de TC preoperatorios (número de lóbulos afectados, presencia de engrosamiento pleural y destrucción pulmonar) y angiografía. datos (número y diámetro de las arterias bronquiales culpables, presencia de NBSA y materiales de embolización). La gravedad de la hemoptisis se graduó y clasificó en tres niveles según el volumen de la hemoptisis: leve (< 100 ml/d), moderada (100-300 ml/d) y masiva (≥ 300 ml/d) [18]. A ocho pacientes se les realizó broncoscopia, TC y angiografía por TC (CTA) a todos los pacientes durante la hospitalización. Podrían mostrar la enfermedad pulmonar subyacente, localizar el origen del sangrado, identificar los orígenes y trayectos de las arterias bronquiales y los NBSA, lo que brinda una alta posibilidad de éxito clínico después de la BAE. La enfermedad pulmonar subyacente incluía bronquiectasias, secuelas de tuberculosis, neumonía crónica y hemoptisis criptogénica. La hemoptisis criptogénica indicó una falta de anomalías parenquimatosas o vasculares específicas en el pulmón, como se observó en la CTA preoperatoria [19]. Engrosamiento pleural > 3 mm fue diagnosticado como patológico [20]. La destrucción irreversible del parénquima caracterizada por adherencias difusas y grandes cavidades se definió como destrucción pulmonar.
.
Arterial…