Resumen
Antecedentes
No existen terapias efectivas para la fibrosis pulmonar (PF) debido a la patogénesis molecular poco clara y la falta de objetivos terapéuticos efectivos. La proteína de dedo de zinc 451 (ZNF451), un regulador transcripcional, desempeña un papel crucial en la patogénesis de varias enfermedades. Sin embargo, su patrón de expresión y función en PF siguen siendo desconocidos. Este estudio fue diseñado para investigar el papel de ZNF451 en la patogénesis de la fibrosis pulmonar.
Métodos
Se utilizaron análisis de conjuntos de datos GEO, RT-PCR y ensayos de inmunotransferencia para examinar la expresión de ZNF451 en PF; Se utilizaron ratones knockout para ZNF451 y lentivirus que sobreexpresan ZNF451 para determinar la importancia de ZNF451 en la progresión de la PF; y se utilizaron ensayos de migración, tinción de inmunofluorescencia y análisis de secuencia de ARN para estudios mecanicistas.
Resultados
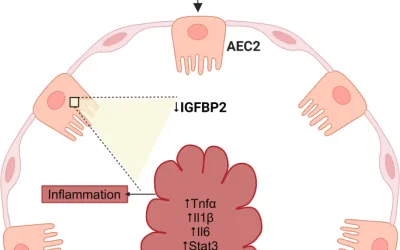
ZNF451 está regulado negativamente y asociado negativamente con la gravedad de la enfermedad en la PF. En comparación con los ratones de tipo salvaje (WT), los ratones knockout para ZNF451 exhibieron cambios de PF mucho más graves. Sin embargo, la sobreexpresión de ZNF451 protege a los ratones de la fibrosis pulmonar inducida por BLM. Mecánicamente, la regulación negativa de ZNF451 desencadena la activación de fibroblastos al aumentar la expresión de PDGFB y posteriormente activar la señalización de PI3K/Akt.
Conclusión
Estos hallazgos descubren un papel fundamental de ZNF451 en la progresión de la PF e introducen un nuevo mecanismo regulador de ZNF451 en la activación de fibroblastos. Nuestro estudio sugiere que ZNF451 sirve como un objetivo terapéutico potencial para la PF y que las estrategias dirigidas a aumentar la expresión de ZNF451 pueden ser enfoques terapéuticos prometedores para la PF.
Introducción
La fibrosis pulmonar (FP) es una enfermedad pulmonar intersticial crónica causada por lesiones persistentes en el parénquima pulmonar acompañadas de una reparación pulmonar desregulada.1, 2). Es un cambio patológico común que se puede observar en una variedad de enfermedades, incluido el lupus eritematoso sistémico, la artritis reumatoide, la esclerosis sistémica y la enfermedad por coronavirus 2019 (COVID-19) (3,4,5). La PF idiopática (FPI) es una forma grave de fibrosis pulmonar con causas desconocidas que afecta aproximadamente a 5 millones de personas en todo el mundo (6). La FPI tiene un mal pronóstico con una tasa de supervivencia media de menos de 3 años (7). Aunque se han aprobado dos terapias, pirfenidona y nintedanib, para el tratamiento de la PF, los estudios clínicos han demostrado que ambas sólo pueden retardar, pero no detener, la progresión de la PF. No existe un tratamiento eficaz para la PF debido a su etiología y patogénesis poco claras. Existe una necesidad urgente de nuevos enfoques terapéuticos para las enfermedades pulmonares fibróticas.
La PF se inicia a partir de una lesión recurrente del epitelio alveolar, seguida de una secreción excesiva de factores proinflamatorios y profibróticos de las células epiteliales lesionadas y de células inmunes reclutadas que desencadenan la diferenciación de los fibroblastos en miofibroblastos.8). Estos miofibroblastos, a su vez, secretan cantidades exageradas de matriz extracelular (MEC), lo que resulta en una destrucción pulmonar irreversible y pérdida de la función respiratoria.9, 10). Se ha informado que múltiples tipos de células, incluidas las células epiteliales, las células inmunes y los fibroblastos, están involucradas en la patogénesis de la fibrosis pulmonar.11, 12). Entre ellos, los fibroblastos actúan como las principales células efectoras de la fibrosis. Las opciones de tratamiento limitadas para la PF se deben a una comprensión poco clara de los mecanismos moleculares que regulan la activación de los fibroblastos en miofibroblastos.
ZNF451, una proteína de dedos de zinc de vertebrados pobremente caracterizada, se identificó inicialmente como una ligasa E3 específica de SUMO2/3 (13,14,15). Además de su función como ligasa E3 que regula la estabilidad de sus sustratos SUMO, como TWIST y PML, ZNF451 también se conoce como cofactor transcripcional (dieciséis, 17). Por ejemplo, Karvenon et al. descubrió que ZNF451 actúa como un coactivador transcripcional para el receptor de andrógenos (AR), lo que lleva a una expresión mejorada de los genes diana de AR (13). Feng et al. reveló que ZNF451 actúa como un correpresor transcripcional para Smad3/4 y, por lo tanto, regula negativamente la señalización de TGF-β (18). Recientemente identificamos ZNF451 como un coactivador transcripcional para SLUG, un regulador clave de la transición epitelial-mesenquimatosa, facilitando así la transcripción de CCL5 mediada por SLUG (19). Se desconoce el papel de ZNF451 en la patogénesis de la fibrosis pulmonar.
En el presente estudio, identificamos a ZNF451 como un regulador clave de la activación de fibroblastos en la progresión de la PF. ZNF451 se expresó en niveles bajos y se asoció con la gravedad de la enfermedad en PF. La sobreexpresión de ZNF451 alivió notablemente, mientras que la pérdida de ZNF451 agravó la fibrosis pulmonar inducida por BLM. Mecánicamente, la expresión reducida de ZNF451 aumentó la expresión de PDGFB, lo que desencadenó la vía de señalización PI3K/Akt para mejorar la activación de los fibroblastos. Nuestros hallazgos presentan a ZNF451 como un objetivo terapéutico para el tratamiento de la PF.
Materiales y métodos
Colección de tejidos pulmonares humanos.
Se obtuvieron muestras frescas de pulmón fibrótico humano de pacientes con PF sometidos a un trasplante de pulmón. Se obtuvieron muestras frescas de pulmón humano normal al menos a 10 cm de distancia de la lesión en pacientes sometidos a cirugía por nódulos pulmonares. Todas las muestras humanas se obtuvieron del Segundo Hospital Xiangya de la Universidad Central Sur. Los protocolos que utilizan muestras humanas fueron aprobados por el Comité de Ética del Centro Nacional de Investigación Clínica del Segundo Hospital Xiangya de la Universidad Central Sur (aprobado no. 2022-052). El consentimiento informado se obtuvo de todos los temas. El estudio se ajustó a los principios descritos en la Declaración de Helsinki.
Cultivo de células
Las células MRC5 se cultivaron en medio mínimo esencial (Thermo Fisher) con 10% de FBS, penicilina, estreptomicina y aminoácidos no esenciales (NEAA) y se mantuvieron a 37 °C y 5% de CO.2.
Estudios en animales
Se adquirieron ratones macho C57BL/6J (8 semanas de edad) de SJA Laboratory Animal Co., Ltd. (Hunan, China). Znf451Los ratones -/- fueron construidos por Cyagen Biosciences Inc. (Suzhou, China). Los ratones fueron criados y alojados en condiciones específicas libres de patógenos en el Centro de Cuidado de Animales del Segundo Hospital Xiangya de la Universidad Central Sur. Todos los experimentos con ratones fueron aprobados por el Comité de Ética del Segundo Hospital Xiangya de la Universidad Central Sur. Los ratones fueron asignados aleatoriamente a grupos experimentales. Los grupos de tratamiento estaban cegados y no se excluyeron valores atípicos de los conjuntos de datos.
Modelo de PF de ratón inducido por bleomicina
El modelo de PF de ratón inducido por bleomicina (BLM) se generó mediante pulverización intratraqueal repetitiva de BLM como se describió anteriormente (20). Brevemente, se anestesiaron ratones (C57Bl/6J, 9-10 semanas de edad) con Avertin (Sigma), 40 mg/kg ip, se intubaron y se les administró una instilación intratraqueal de 1 U/kg de BLM (Selleck) o un volumen equivalente de solución salina un total de 6 veces, con intervalos de 14 días entre cada instilación. Los ratones fueron sacrificados mediante anestesia excesiva 10 días después de la última exposición a BLM.
Aislamiento de fibroblastos primarios de pulmón de ratón.
Los fibroblastos de pulmón primarios se aislaron de ratones como se informó anteriormente (21). Después de cortar el tejido pulmonar fresco de ratones tratados con o sin BLM, el tejido se cortó en trozos de 1 mm.3 piezas en DMEM. Después de la centrifugación a 1500 rpm durante 10 minutos, la suspensión de tejido se suspendió en DMEM que contenía FBS al 15% y se distribuyó uniformemente en un plato de 10 cm. Después de 4 a 5 días de cultivo, se recogieron los fibroblastos adherentes para su paso o ensayos. Los fibroblastos pulmonares primarios se cultivaron durante no más de 3 pases.
Tinción de inmunofluorescencia
Las células cultivadas en cubreobjetos se fijaron con formaldehído al 4% (v/v) a temperatura ambiente durante 15 minutos y se permeabilizaron con Triton X-100 al 0,5% a temperatura ambiente durante 20 minutos. Después de bloquear con BSA al 3% a temperatura ambiente durante 30 minutos, las células se incubaron con anticuerpos contra la actina alfa del músculo liso (α-SMA) a 4 °C durante la noche, seguido de tinción con anticuerpos anti-ratón conjugados con Alexa Fluor 594 a temperatura ambiente. temperatura. Para la visualización de actina F, las células se tiñeron con Alexa Fluor™ 488-faloidina durante 15 minutos a temperatura ambiente. Las secciones se montaron con un medio de montaje que contenía 4,6-diamidino-2-fenilindol (DAPI) y se tomaron imágenes utilizando un microscopio confocal de barrido láser Zeiss LSM 780.
inmunotransferencia
Se lisaron tejidos o células de pulmón de ratón con tampón de extracción de lisis RIPA (Beyotime Technology) junto con un cóctel inhibidor de proteasa (Selleck). La concentración de proteína total se determinó mediante un kit de reactivos de ensayo de proteínas BCA (Applygen Technologies Inc.) según el protocolo del fabricante. La proteína total (20 µg) se cargó y se separó mediante SDS-PAGE al 10% y luego se transfirió a una membrana de PVDF. Las membranas se bloquearon con leche desnatada al 5 % en tampón TBST durante 1 h y luego se incubaron con anticuerpos primarios durante la noche a 4 ° C, seguido de la incubación con anticuerpos secundarios conjugados con peroxidasa de rábano picante. Se utilizaron los siguientes anticuerpos: anti-ZNF451 (Proteintech), anti-α-SMA (BOSTER), anti-Col1 (Abcam) y anti-GAPDH (ZSGB BIO). La señalización se visualizó utilizando un ChemiDocTM XRS+ con el software Image LabTM (Bio-Rad, Hercules, California, EE. UU.) con un kit ECL (Tanon).
Aislamiento de ARN y RT‒PCR cuantitativa.
El ARN total de las células se preparó utilizando el kit de extracción de ARN total EastepTM (Promega, Beijing, China), y el ADNc se sintetizó utilizando EasyScript One-Step GDNA Removal and cDNA Synthesis SuperMix (TransGen, Beijing, China). Los análisis qRT‒PCR se realizaron utilizando 2X qPCR Master Mix (KAPA BIOSYSTEMS, Wilmington, Massachusetts, EE. UU.) y Applied Biosystems® ViiA™ Real-Time PCR System (Applied Biosystems, Carlsbad, CA, EE. UU.). Todas las reacciones se llevaron a cabo por triplicado. Las secuencias de cebadores de PCR para qRT‒PCR se enumeran en la Tabla T1.
Ensayo de migración celular
Los fibroblastos se cultivaron en DMEM sin suero durante 24 h antes de los ensayos de migración celular. Este ensayo se realizó utilizando insertos Transwell (tamaño de poro de 8 μm) en placas de cultivo de 24 pocillos. Las células se sembraron (5 × 105 células/mL) en la cámara superior en medio libre de FBS, mientras que la cámara inferior…