Resumen
La pandemia global de la enfermedad del coronavirus 2019 (Covid-19) es causada por el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2). Sin embargo, nuestra comprensión de la inflamación inducida por SARS-CoV-2 en las células epiteliales alveolares sigue siendo muy limitada. Las contribuciones de la proteína de unión al factor de crecimiento similar a la insulina intracelular (IGFBP2) a la patogénesis SARS-CoV-2 tampoco están claras. En este estudio, hemos descubierto un papel crítico para IGFBP2, específicamente en células epiteliales alveolares tipo 2 (AEC2), en la inmunopatogénesis de Covid-19. Usando la secuenciación de ARN a granel, mostramos que la expresión de ARNm de IGFBP2 está significativamente regulada en las células AEC2 primarias aisladas de regiones pulmonares fibróticas de pacientes con Síndrome de dificultad respiratoria (ARD) de COVID-19 (ARDS) en comparación con aquellos con fibrosis pulmonar idiopática (IPF) solo o IPF con antecedentes de COVID-19. Utilizando la inmunohistoquímica multicolor, demostramos que IGFBP2 y sus ligandos selectivos IGF1 e IGF2 se redujeron significativamente en las células AEC2 de pacientes con asquerosos, IPF solos o IPF con historia covid que en aquellos de controles de donantes de la edad. Además, demostramos que la expresión lentiviral de IGFBP2 redujo significativamente la expresión de ARNm de las citocinas proinflamatorias: TNF-α, IL1β, IL6, STAT3, STAT6 y receptores de quimiocinas: CCR2 y CCR5, en células epiteliales pulmonares de ratón desafiadas con un inicio de proteínas SARS-CoV-2 (SS2; 500 NG/ML). Finalmente, demostramos niveles más altos de citocinas: TNF-α; IL-6 y receptor de quimiocinas: CCR5 en células AEC2 de pacientes con costos en comparación con el IPF solo y el IPF con pacientes con antecedentes de CoVID. En total, estos datos sugieren que las propiedades antiinflamatorias de IGFBP2 en las células AEC2 y su entrega localizada pueden servir como una estrategia terapéutica potencial para los pacientes con COVID-19.
Abstracto gráfico
Introducción
Síndrome respiratorio agudo severo Coronavirus 2 (SARS-COV-2) es la causa de la reciente pandemia de enfermedad del coronavirus 2019 (Covid-19). Después de ingresar a través de la cavidad nasal, SARS-CoV-2 infecta principalmente a las células ciliadas y se libera en los tractos respiratorios (1). A medida que el virus se propaga, la manifestación clínica varía de síntomas leve hasta síndrome de angustia respiratoria grave o muerte (2). A través de la interacción de la glucoproteína de espiga con el receptor de enzima convertidora de angiotensina (ACE2), SARS-CoV-2 infecta células humanas, incluidas las células epiteliales alveolares ((3). La extensión de la infección SARS-CoV-2 en el espacio alveolar produce hipoxia progresiva asociada con la infiltración pulmonar. Además, la infección SARS-CoV-2 de las células alveolares induce inundaciones alveolar e infiltración de células inflamatorias (4). Los procesos patológicos incluyen daño alveolar difuso, formación de la membrana hialina y lesión epitelial y microvascular5, 6). Sin embargo, la fibrosis pulmonar es la complicación más significativa a largo plazo de CoVID-19 (7, 8).
En los pulmones, un equilibrio de respuestas proinflamatorias y antiinflamatorias es vital para la homeostasis inmune. Sin embargo, una tormenta de citocinas desencadenada por la infección SARS-CoV-2 puede dar como resultado una manifestación clínica grave conocida como síndrome de dificultad respiratoria de Covid-agudo (Covid-Lands) (9, 10). Durante la patogénesis de los cuales, los macrófagos alveolares liberan niveles elevados de citocinas y quimiocinas y células epiteliales (11). Los estudios de secuenciación de ARN de células individuales han demostrado que las células epiteliales alveolares tipo II (AEC2) son susceptibles a la infección SARS-CoV-2 habilitada por los receptores ACE2 y la actividad de proteasa TMPRSS2 (12, 13). Principalmente, la infección de las células AEC2 por SARS-CoV-2 que impulsa el SDRA en casos severos de CoVID-19 podría ser un importante contribuyente a la fibrosis inducida por SADS. Además, un sistema modelo de células AEC2 derivadas de células madre pluripotentes después de la infección Covid reveló una mayor expresión de genes de citocinas proinflamatorias que incluyen IL-6, TNF, CXCL-12 y CXCL8 y la regulación negativa de los genes asociados a tensioactivos, incluidos SFTPC, SFTPA1 y LAMP3 (LAMP3 ((LAMP3 ((LAMP3 ((LAMP3 ((LAMP3 ((LAMP3 ((LAMP3 ((LAMP3 (((((14). El análisis del transcriptoma de un cultivo celular organoide 3D AEC2 reveló la expresión diferencial de genes asociados al interferón, y los análisis inmunológicos mostraron la pérdida de proteína C tensioactiva y caspasa 3, recapitulando las características de los pulmones Covid-19 (15). Las citocinas inflamatorias se liberan mediante la infección de las células epiteliales alveolares y, en consecuencia, pueden desencadenar una respuesta de macrófagos profibrótico y fibrosis pulmonar a través de la acumulación de macrófagos (16). Debido a que las células AEC2 actúan como células madre de tejidos en el espacio alveolar, su disfunción no solo atrae a más macrófagos sino que también disminuye la capacidad regenerativa, lo que agrava la fibrosis pulmonar. Por lo tanto, es crucial comprender cómo la infección SARS-CoV-2 cambia la expresión diferencial y las vías de señalización de las células AEC2. Estas ideas allanan el desarrollo de nuevas terapias antiinflamatorias que se necesitan para reducir los impactos secundarios de la infección SARS-CoV-2.
La proteína 2 de unión al factor de crecimiento similar a la insulina (IGFBP2) juega un papel fundamental en los procesos celulares que incluyen, entre otros, proliferación, diferenciación y senescencia (17). Nuestro estudio anterior demostró que la pérdida de IGFBP2 funciona específicamente en las células AEC2 promueve la fibrosis pulmonar (18). En el presente estudio, utilizando la secuenciación total de ARN, nuestro objetivo fue descubrir los mecanismos potenciales que dañan las células AEC2 lesionadas después de la infección SARS-CoV-2. Entre los genes diferenciales identificados, nos centramos en IGFBP2, lo que podría regular las condiciones inflamatorias locales en las células AEC2. Por lo tanto, investigamos si IGFBP2 regula las citocinas inflamatorias y las quimiocinas específicamente en las células AEC2 después de la lesión de proteínas SARS-CoV-2 Spike. Utilizando la secuenciación de ARN a granel y la inmunohistoquímica multicolor, demostramos que IGFBP2 se redujo significativamente en las células AEC2 de pacientes con dardes covid, IPF solos o IPF con antecedentes de COVID-19 (IPF con historia de CovID) en comparación con controles de donantes sanos. Utilizando los enfoques de expresión lentiviral, mostramos que IGFBP2 redujo significativamente la expresión de ARNm de citocinas proinflamatorias (TNF-α, IL1β, IL6, STAT3, STAT6 y receptores de quimiocinas: CCR2 y CCR5, en EPITHELIAL PITHELIAL DE RAUNO después de la exposición a las células SARS-CoV-2 (S2). También demostramos que la transducción lentiviral de IGF1 aumentó significativamente la expresión de ARNm de citocinas (TNF-α, IL1β, IL6 y receptores de quimiocinas: CCR2, CCR5 e IRF3; Mientras que la transducción lentiviral de IGF2 aumentó significativamente la expresión de ARNm de TNF-α y CCR5 en células epiteliales pulmonares de ratón después de la exposición a la proteína SARS-CoV-2 Spike. Además, demostramos que las citocinas, TNF-α e IL-6 y quimiocina, los niveles de proteína CCR5 se elevaron significativamente en las células AEC2 de pacientes con dardas covéidas en comparación con los pacientes con IPF solo o IPF con antecedentes de Covid. Colectivamente, estos hallazgos sugieren que IGFBP2 está regulado negativamente en las células AEC2 y su expresión dirigida puede regular la inflamación inducida por SARS-CoV-2 y, por lo tanto, producir opciones terapéuticas para pacientes con COVID-19.
Resultados
Histología pulmonar humana de Covid-19 severa y moderada
Para examinar los cambios histológicos impulsados por la infección SARS-CoV-2, realizamos la tinción de tricromo de H&E y Masson en regiones pulmonares obtenidas de pacientes diagnosticados con asquerosos (severos), IPF solo o IPF con antecedentes covid (moderado). Los análisis de tinción de H&E revelaron estructuras pulmonares anormales con heterogeneidad en pacientes con dardas de calo en comparación con pacientes de los otros grupos de enfermedades. Los análisis de escala de Ashcroft mostraron una puntuación patológica significativamente mayor en todos los grupos de enfermedades pulmonares en comparación con los controles de los donantes (Fig. 1A, b). Además, se observó infiltración parenquimatosa linfocítica en las regiones pulmonares de pacientes diagnosticados con asquerosos en comparación con el parénquima fibrótico observado en pacientes diagnosticados con IPF solo, o IPF con antecedentes covid (Fig. 1DO). A continuación, realizamos la tinción de tricromo de Masson para evaluar el contenido de fibrosis. La tinción del tricromo reveló un mayor contenido de colágeno en los pulmones de todos los grupos de enfermedades en comparación con los controles de los donantes (Fig. 1D, e). Juntos, estos datos sugieren que el contenido total de colágeno pulmonar fue significativamente mayor en pacientes con enfermedades pulmonares Covid y noóbicas.
Fig. 1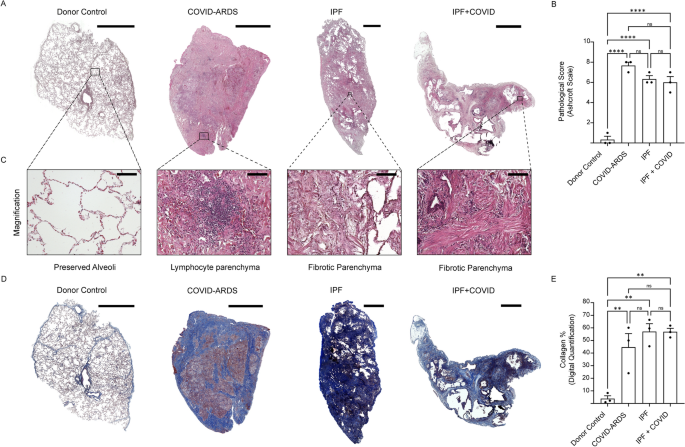
Patología de las secciones de pulmón humano de pacientes con síndrome de dificultad respiratoria aguda covid (ARDS), fibrosis pulmonar idiopática (IPF) o IPF con antecedentes de Covid-19. Imágenes representativas de (A) H&E y (D) Las secciones de pulmón fibróticas manchadas de Trichrome de Masson de controles de donantes (sanos) y pacientes con asquerosos, IPF solo o IPF con historial covid. Barras de escala, 3000 μm. B Cuantificación de la puntuación patológica para las imágenes de pulmón teñidas con H&E de pacientes con dardas de Covid, IPF solo o IPF con historial de Covid. do Los paneles inferiores muestran imágenes de tinción histológica H&E magnificadas de los controles de donantes (sanos) y pacientes con asquerosos, IPF solo o IPF con historial covid. Barras de escala, 100 μm. mi Cuantificación digital de las imágenes de pulmón manchadas de Tricrome de Masson de pacientes con asquerosos, IPF solo o IPF con historial de Covid. Los datos se presentan como media ± SEM. Ns, no significativo; **** P <0.0001, ANOVA. N = 3 para cada grupo (controles de donantes (saludables), lados de covid, IPF solo e IPF con historial covid)
Imagen de tamaño completoAnálisis de secuenciación de ARN a granel de células AEC2 en Wards Covid e IPF con historial covid
Para investigar más a fondo los cambios transcriptómicos entre pacientes con asquerosos, IPF solo o IPF con antecedentes moderados de Covid, realizamos secuenciación de ARN a granel en células AEC2 primarias aisladas de regiones pulmonares fibróticas de los pacientes respectivos. Análisis de expresión de genes diferenciales Los genes replicados identificados, a saber, Snord89, miR627, miR320C1, Snord95, Snord1c, PTPRD-AS1, Snord41, miR3173, ACR, C8orf49 y los genes regulados hacia abajo, Namely ST8SIA1, Linc00521, WNT2, LPA, C14Orf180, TTAMELY ST8SIA1, LINC00521, WNT2, LPA, C14LOT140, TEMPLETOS, TOMBRES WDR88, SAG, …
(Tagstotranslate) Neumología/sistema respiratorio