Resumen
Antecedentes
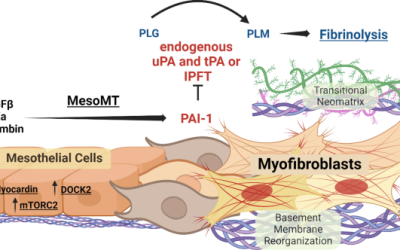
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune que involucra daños en órganos múltiples. La hipertensión arterial pulmonar (HAP) es una de las complicaciones potencialmente mortales del LES. La causa subyacente de la hipertensión arterial pulmonar asociada a lupus eritematoso sistémico no se ha comprendido completamente. Además de los mecanismos implicados en el desarrollo de la HAP, como el daño a las células endoteliales, la activación aberrante del sistema inmune también juega un papel sustancial en la patogénesis de la TIP-PAH.
Métodos
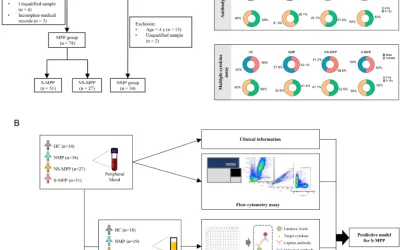
En este estudio, se obtuvieron muestras de sangre periférica de 100 pacientes con SLE-PAH y 95 pacientes con LES sin HAP (SLE-noPAH) para la secuenciación de ARN y el análisis transcriptómico integral. El análisis de enriquecimiento de la vía se realizó en base a genes expresados diferencialmente (DEG) entre SLE-PAH y SLE-nopah para dilucidar los mecanismos que potencialmente impulsan el desarrollo de HAP en pacientes con LES. Utilizando la factorización de la matriz no negativa de consenso (CNMF), también realizamos un análisis detallado para identificar subgrupos distintos dentro de la población de LIG-PAH. Mientras tanto, se realizó el análisis de interacción proteína-proteína (PPI) y se detectaron los genes de HUB entre los subgrupos de SLIP-PAH. También se descubrió que los factores de transcripción comunes (TF) de los genes del centro detectados sirven como objetivos terapéuticos potenciales.
Resultados
Se encontró que las vías de señalización inflamatoria, especialmente aquellas que involucran interferón y TNFα, juegan un papel importante en el SLIP-Pah. Utilizando el método CNMF, se delinearon tres subgrupos únicos de pacientes con SLIP-PAH, cada uno caracterizado por un nivel distinto de actividad inflamatoria. Específicamente, el alto subgrupo de inflamación, marcado por la actividad de la interleucina-6 (IL-6), exhibió una forma más suave de HAP. En contraste, el subgrupo con inflamación moderada mostró los síntomas de HAP más pronunciados. Otros análisis de enriquecimiento de la enfermedad revelaron que, más allá de las vías inflamatorias desreguladas, los pacientes con el HAP más grave exhibieron perfiles transcriptómicos patogénicos distintos que interrumpieron la homeostasis del músculo liso vascular, un componente crítico de la salud vascular. En el subgrupo más severamente afectado, se identificaron 13 genes HUB. Además, se descubrieron dos factores de transcripción comúnmente asociados con estos genes, KLF1 y GATA1, lo que puede servir como objetivos terapéuticos potenciales.
Conclusión
Nuestra investigación establece la inflamación como un impulsor clave en el desarrollo de SLIP-Pah. Los pacientes que presentaron desregulaciones concurrentes en respuestas inflamatorias junto con marcadores patogénicos específicos de HAP exhibieron un aumento marcado en la gravedad de su HAP. Las ideas obtenidas de nuestro análisis transcriptómico revelan la intrincada interacción entre los mecanismos inflamatorios y los sustratos moleculares de la HAP. Esta comprensión matizada allana el camino para enfoques terapéuticos más específicos y efectivos para SLIP-Pah.
Introducción
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune sistémica que puede demostrar daños múltiples graves. La hipertensión arterial pulmonar (HAP) es una complicación grave de LES que puede afectar aproximadamente el 3% de LES, con un pronóstico desfavorable que a menudo sirve como una causa importante de mortalidad entre los pacientes con LES (1,2,3). La HAP también puede afectar significativamente la capacidad física del paciente y disminuir su calidad de vida (4,5,6,7).
La HAP es un subtipo de hipertensión pulmonar, a menudo designada como pH tipo I (8). El mecanismo subyacente de SLIP-Pah aún no se ha entendido a fondo. La fisiopatología de SLIP-PAH difiere dramáticamente de otro HAP relacionado con la enfermedad de los tejidos no connectivos (CTD-PAH). La fisiopatología única de SLIP-Pah está vinculada a la actividad aberrante del sistema inmune y varias investigaciones han encontrado una asociación entre complejos inmunes y SLIP-Pah (9,10,11). Se ha informado que la positividad del anticuerpo antirribonucleoproteína aumenta el riesgo de HAP en pacientes con LES (9). La deposición de anticuerpos antinucleares, inmunoglobulinas y complemento en los vasos pulmonares, un hallazgo que recuerda a la deposición del complejo inmune en la nefritis lupus, se ha informado en varios estudios ((10,11,12,13). Una nueva mutación HLA-DQA1*03: 02 en la región principal del complejo de histocompatibilidad (MHC) se ha asociado con un mal pronóstico en SLIP-Pah. Este hallazgo sugiere un papel para la función aberrante de las células inmunes en la patogénesis de SLIP-PAH (14). La mutación de HLA-DQA1*03: 02 influye en la formación de un homodímero de heterodímeros HLA-DQ αβ y la unión de la molécula coreceptor TCell CD4 +. La afinidad del MHC/péptido y el receptor de células T aumenta y, por lo tanto, conduce a la activación de las células T. Además, se ha demostrado que la hiperactivación de células T es un contribuyente significativo tanto para la inflamación como para la remodelación vascular en SLE-pah (15). Además, investigaciones anteriores demostraron que la terapia inmunosupresora podría conducir a mejores resultados para los pacientes con SLIE-PAH (16). Estos estudios demostraron colectivamente que, además de los mecanismos específicos de la HAP, la inflamación juega un papel crucial en el desarrollo de SLIP-PAH.
La investigación previa de OMICS sobre SLIP-PAH se ha concentrado predominantemente en la genómica, dejando un vacío significativo en el examen de transcriptomas específicos para esta condición (14, 15, 17, 18). Hasta donde sabemos, nuestro estudio marca la primera aplicación integral de la secuenciación de ARN a una cohorte considerable de pacientes con SLIP-PaH. Esto nos ha permitido delinear subgrupos discernibles dentro de la población de SLIP-PAH, respaldados por sus firmas transcriptómicas únicas. Además, realizamos un análisis exhaustivo que abarca la expresión génica diferencial, las interacciones proteína-proteína y la identificación de genes HUB, junto con el análisis de enriquecimiento de la enfermedad, para iluminar los intrincados mecanismos patógenos en juego en SLE-PAH.
Métodos
Pacientes
El Grupo de Investigación de Tratamiento e Investigación de LES de China (CSTAR) es la cohorte nacional más grande que sigue a los pacientes con LES en China (19). Este estudio basado en la cohorte CSTAR. Todos los pacientes inscritos cumplieron con los criterios de clasificación de clínicas de colaboración de Lupus International (SLICC) de Lupus 2012 o la Liga Europea de 2019 contra el Reumatismo /Criterios de Clasificación del Colegio Americano de Reumatología (Eular /ACR) para LES ((20, 21). Los pacientes con SLIA-PAH en este estudio fueron diagnosticados con cateterismo cardíaco derecho (RHC) y cumplieron los criterios hemodinámicos: (1) presión arterial pulmonar media (MPAP)> 20 mmHg; (2) Resistencia vascular pulmonar (PVR)> 2wu (3) y PAWP ≤ 15 mmhg (8). Todos los pacientes con SLE-nopah no mostraron síndromes relacionados con la HAP ni signos de pH de eco, y todos ellos tenían velocidad de regurgitación tricúspide pico ≤ 2.8 m/s. Los pacientes usaron esteroides (prednisona> 30 mg/ día de dosis oral o de pulso) o agentes biológicos como rituximab fueron excluidos. Los pacientes con cualquier cambio en la terapia con ácido micofenólico, azatioprina o metotrexato en los últimos 30 días también se excluyeron para reducir las diferencias causadas por la terapia inmunosupresora. Se registraron características demográficas, evaluaciones clínicas, prueba de laboratorio y gestión médica. Se aplicó el sistema de evaluación de riesgo de cuatro estratos Compera 2.0 para evaluar el HAP, los pacientes dentro de estratos moderados o de alto riesgo se designaron como de alto riesgo y los otros se definieron como de bajo riesgo (22). Todos los pacientes dieron permiso informado por escrito. En general, se incluyeron 100 PAH de SLIE y 95 sin pacientes con HAP en este estudio.
Procesamiento y secuenciación de muestras
Se recogieron muestras de sangre periférica de los pacientes. Los eritrocitos se lisaron con tampón de lising de cloruro de amonio (Gibco). El ARN total se extrajo de las muestras de sangre periférica a través del kit de ARN sanguíneo Paxgene® (preanalytix). Se aplicaron perlas de captura de ARNm de VAHTM (Yeasen) para aislar ARNm del ARN total. Cuando la cantidad de ARNm cayera dentro del rango de 10 a 40 nanogramos (NG), continúe con la construcción normal de la biblioteca. Se utilizó Hieff NGS Ultima Dual Mode-Mode MRNA Library Prep Kit para Illumina (Yeasen) para la construcción de la biblioteca. El producto se amplificó a través de PCR con cicladores térmicos1000 (Bio-Rad) para generar la biblioteca. Finalmente, se estableció una biblioteca de ARNr agotada y específica de la cadena y luego se sometió a control de calidad (QC) a través de QPCR (Stepone Plus (ABI)), lo que garantiza una concentración superior a 3 nM. Las bibliotecas que pasaron el QC estaban programadas para la secuenciación posterior. La secuenciación fue realizada por NovaseQ 6000 (Illumina) con el modo de al final del par de 150 pb.
Procesamiento de datos y control de calidad
Los datos de RNA-seq se emitieron en forma FASTQ y el control de calidad se realizó a través de FASTQC (V 0.11.9) con parámetros predeterminados y todas las muestras pasan el QC. Los datos de secuenciación se alinearon con la secuencia de referencia GRCH38 usando Star (V 2.7.10b) (23). Los archivos SAM se ordenaron luego con SamTools (V 1.16.1), y la salida de archivos BAM de SamTools se transformó para leer los recuentos a través de FeatRecounts (parte de Subread). Los datos de conteo de lectura se procesaron en R (v 4.3.1). Los genes de baja expresión (los recuentos de lectura del gen fueron inferiores a 10 en más de 100 muestras) se consideraron como ruido y se filtraron. Los efectos por lotes de los datos se examinaron con el análisis de componentes principales (Fig. Suplementaria. 1). Los valores de transcripciones por millón (TPM) se calcularon a partir de los recuentos de genes con la siguiente fórmula (: tpm = frac {{ left ({Count/Efection : Longitud} Right)*{{10}^6}}}} {{Sum : Left (count/Efection : Longi right)}};. ):.
Análisis diferencial de expresión génica
Para detectar el gen (DEG) expresado diferencialmente, el paquete R DESEQ2 se utilizó con recuentos de lectura de 18,630 genes como entrada. El análisis de expresión génica diferencial se realizó entre los pacientes con SLE-PAH y SLE-noPAH para demostrar los mecanismos subyacentes a SLE-Pah. Los genes con el cambio de plegamiento LOG2 absoluto en 0.5 y el valor de P ajustado inferior a 0.05 se definieron como genes expresados diferencialmente.
Análisis de enriquecimiento de la vía
A…
(Tagstotranslate) Neumología/sistema respiratorio