Abstracto
Fondo
Las anomalías pulmonares intersticiales (ILA) son hallazgos en la TC sugestivos de enfermedad pulmonar intersticial en individuos sin diagnóstico previo o sospecha de EPI. Estudios previos han demostrado que las ILA se asocian con resultados clínicamente significativos, incluida la mortalidad. El objetivo de este estudio fue determinar la prevalencia de ILA en un gran programa de detección de cáncer de pulmón con TC y la asociación con resultados clínicamente significativos que incluyen mortalidad, hospitalizaciones, cáncer y diagnóstico de EPI.
Métodos
Este fue un estudio retrospectivo de personas inscritas en un programa de detección de cáncer de pulmón por TC de 2012 a 2014. Las TC de referencia y longitudinales se calificaron para ILA según las pautas de la Sociedad Fleischner. Los análisis primarios examinaron la asociación entre el ILA inicial y la mortalidad, la hospitalización por cualquier causa y la incidencia de cáncer de pulmón. Se generaron gráficos de Kaplan-Meier para visualizar las asociaciones entre ILA y el cáncer de pulmón y la mortalidad por todas las causas. Se utilizaron modelos de riesgos proporcionales de regresión de Cox para probar esta asociación en modelos univariados y multivariados.
Resultados
1699 sujetos cumplieron los criterios de inclusión. 41 (2,4 %) tenían ILA y 101 (5,9 %) tenían ILA indeterminado en las TC basales. Se diagnosticó EPI en 10 (24,4 %) de 41 con ILA en la TC inicial con un tiempo medio desde la TC inicial hasta el diagnóstico de 4,47 ± 2,72 años. En el modelo multivariable, la presencia de ILA siguió siendo un predictor significativo de muerte, HR 3,87 (2,07, 7,21; p < 0,001) cuando se ajustó por edad, sexo, IMC, paquete-año y tabaquismo activo, pero no de cáncer de pulmón y cualquier causa. Admisión hospitalaria. Aproximadamente el 50% con ILA inicial tuvo progresión en la exploración longitudinal.
Conclusiones
Los ILA identificados en los exámenes de detección de cáncer de pulmón de referencia están asociados con la mortalidad por todas las causas. Además, una proporción significativa de pacientes con ILA son posteriormente diagnosticados con ILD y tienen progresión de CT en exploraciones longitudinales.
Número de registro de prueba: ClinicalTrials.gov; Nº: NCT04503044.
Fondo
Las anomalías pulmonares intersticiales (ILA) son hallazgos de tomografía computarizada que sugieren enfermedad pulmonar intersticial (ILD). Estos se pueden observar en individuos que no tienen un diagnóstico previo o sospecha de (EPI) [1,2,3]. Se ha demostrado una asociación entre ILA y resultados clínicos importantes, incluida la mortalidad.[4,5,6] y la incidencia de cáncer de pulmón [7, 8]. Un subgrupo de personas con ILA puede tener ILD no diagnosticada, incluida la ILD fibrótica progresiva [9]. La identificación de ILA puede permitir un diagnóstico de etapa más temprana de ILD y puede ayudar a maximizar el beneficio de las terapias antifibróticas que se han desarrollado en la última década. [9,10,11,12,13].
La EPI fibrótica progresiva se encuentra entre las formas clínicamente más significativas de EPI con respecto a la morbilidad y la mortalidad. [14,15,16]. La fibrosis pulmonar idiopática (FPI), la EPI fibrótica progresiva más común, tiene una mediana de supervivencia de solo 3 a 4 años. [17, 18]. A pesar del deterioro clínico a menudo rápido, los retrasos en el reconocimiento y diagnóstico de la EPI, específicamente de la FPI, son comunes, con una mediana de tiempo hasta el diagnóstico de 1 a 3 años después del inicio de los síntomas. [19].
La evaluación de cohortes de detección de cáncer de pulmón por TC (CTLS) puede brindar una oportunidad para identificar ILA e ILD no diagnosticadas. Los individuos en estas cohortes tienen un alto riesgo de ILD en virtud de su historial de tabaquismo, y la mayoría son seguidos durante un período de años que puede capturar la progresión. En este estudio, evaluamos la prevalencia de ILA, las asociaciones con mortalidad, hospitalización y cáncer de pulmón, y la incidencia y el momento del diagnóstico posterior de EPI, incluida la FPI, entre los participantes en el programa clínico CTLS de nuestra institución.
Métodos
Población de estudio
Realizamos un estudio retrospectivo de un solo centro aprobado por la junta de revisión institucional. Todos los exámenes clínicos CTLS realizados desde el 1 de enerocalle2012, hasta el 30 de septiembreel, 2014, sobre participantes que tenían un médico de atención primaria dentro de la red (n = 1703). Este período de inscripción se eligió para permitir un período de seguimiento de 5 años desde la última exploración de referencia. El conjunto de datos se cerró el 30 de septiembre.el2019, excepto la toma de datos sobre derivación pulmonar y diagnóstico de EPI, que se cerró el 31 de octubrecalle, 2020. Para calificar para nuestro estudio, las personas tenían que cumplir con los criterios de alto riesgo de cáncer de pulmón de la versión 1.2012 de las Pautas® para la detección del cáncer de pulmón de la National Comprehensive Cancer Network (NCCN). Los afiliados estaban asintomáticos y tenían una orden médica para CTLS, no habían tenido cáncer de pulmón durante ≥ 5 años y no tenían enfermedad metastásica conocida [20]. Se excluyeron las personas con antecedentes documentados de EPI.
Las exploraciones de seguimiento utilizadas para evaluar la progresión de ILA se designaron por rondas de detección anuales, donde T0 representa la exploración inicial y T4 representa la quinta ronda de detección. Cada ronda de detección finalizó con una exploración negativa (Lung-RADS® 1 o 2) y la siguiente ronda de detección se determinó mediante el primer examen de detección al menos 11 meses (335 días) después de esa exploración negativa. Los individuos que tenían una neoplasia maligna fueron censurados en el momento de la primera exploración positiva. Aquellos con exploraciones de detección T4 fueron calificados para la progresión (n = 652).
Variables clínicas
Las variables demográficas y clínicas de referencia, que incluyen edad, sexo, etnia, IMC, antecedentes de tabaquismo, se recopilaron prospectivamente como parte del programa CTLS y se almacenaron en un depósito de datos centralizado como se describió anteriormente. [21, 22]. Variables clínicas adicionales, incluidos el cáncer, la mortalidad, la causa de la muerte, la fecha de la remisión pulmonar, el motivo de la remisión pulmonar y el diagnóstico de EPI, que aún no estaban disponibles en este depósito de datos, se recopilaron retrospectivamente mediante revisión manual del registro médico electrónico o se extrajeron directamente de el EMR y se almacena utilizando una base de datos diseñada a medida (FileMaker ProVersion 11; Filemaker Inc, Santa Clara, California). Los ingresos hospitalarios se recopilaron utilizando los datos de codificación administrativa de Lahey con la hospitalización definida como la primera hospitalización después de la exploración inicial.
análisis de TC
Los exámenes CTLS adquiridos clínicamente se realizaron en escáneres de TC multidetector de ≥ 64 filas (LightSpeed VCT y Discovery VCT [GE Medical Systems, Milwaukee, Wisconsin]; Definición de somatoma [Siemens AG, Erlangen, Germany]; tic [Philips Medical Systems North America, Cambridge, Massachusetts]) a 100 kV y de 30 a 100 mA, según el escáner y la disponibilidad del software de reconstrucción iterativa. Las imágenes axiales se obtuvieron con un grosor de 1,25 a 1,5 mm con un 50 % de superposición y se reconstruyeron con tejidos blandos y núcleos pulmonares. [23].
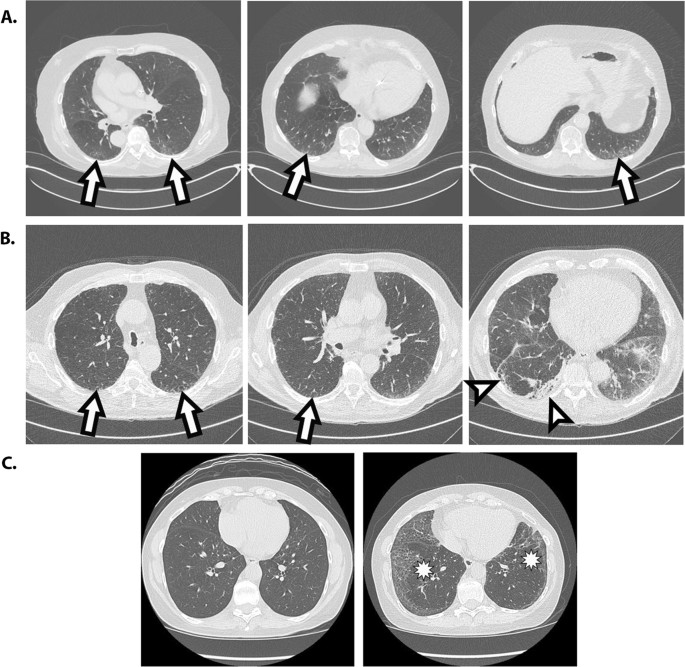
Las imágenes de TC se puntuaron cualitativamente de forma retrospectiva para determinar la presencia y la naturaleza de ILA utilizando Philips PACS y monitores de grado clínico para la revisión de imágenes. La puntuación fue realizada de forma independiente por dos radiólogos torácicos (BJM, JH). Las puntuaciones discordantes entre los dos radiólogos fueron posteriormente puntuadas por un tercer lector, un neumólogo con experiencia en ILD (LG). Los descriptores utilizados para ILA se definieron con base en el documento de posición de la Sociedad Fleischner [3]. La presencia de ILA se calificó como Sí/No/Indeterminado. Las características de ILA que se calificaron incluyen: A) vidrio esmerilado no dependiente, B) anomalías reticulares, C) bronquiectasias por tracción, D) panal de abeja y E) quistes. El ILA indeterminado se definió como opacidad en vidrio esmerilado focal o unilateral, reticulación focal o unilateral y opacidad en vidrio esmerilado en parches (< 5% del pulmón) [1].
Neumonía intersticial habitual
Las ILA se clasificaron adicionalmente para la neumonía intersticial habitual (NIU) (diagnóstico alternativo típico, probable, indeterminado) según los criterios ATS/Fleischner [24, 25]. Cifra 1 muestra ejemplos de personas con ILA (A) e ILA que cumplen los criterios probables de UIP (B).