Resumen
Antecedentes
La enfermedad crónica de las vías respiratorias (EAC) se caracteriza por la inflamación crónica de las vías respiratorias y la colonización de los pulmones por patógenos proinflamatorios. Sin embargo, si bien hay otras especies bacterianas presentes en las vías respiratorias inferiores, no se comprende completamente cómo influyen en la inflamación. Nuestro objetivo fue identificar nuevas especies antiinflamatorias presentes en muestras de las vías respiratorias inferiores de pacientes con EAC.
Métodos
Se analizaron datos emparejados del microbioma del esputo y de marcadores inflamatorios de adultos con EAC en tres cohortes separadas (asma y bronquiectasias australianas, bronquiectasias escocesas) mediante análisis discriminante lineal de tamaño del efecto (LEfSE) y análisis de correlación de Spearman para identificar especies asociadas con un perfil inflamatorio bajo en pacientes. .
Resultados
Identificamos el género Aggregatibacter como más abundante en pacientes con niveles más bajos de marcadores inflamatorios de las vías respiratorias en dos cohortes de CAD (asma australiana y bronquiectasias). Además, la abundancia relativa de Aggregatibacter se correlacionó inversamente con los niveles de IL-8 (bronquiectasia australiana) e IL-1β en el esputo (asma y bronquiectasia australianas). Las pruebas in vitro posteriores, utilizando un modelo tridimensional de células epiteliales pulmonares fisiológicamente relevantes, revelaron que Aggregatibacter spp. (es decir, A. actinomycetemcomitans, A. aphrophilus) y su sobrenadante libre de células ejercieron actividad antiinflamatoria sin influir en la viabilidad de la célula huésped.
Conclusiones
Estos hallazgos sugieren que Aggregatibacter spp. podría actuar para reducir la inflamación de las vías respiratorias en pacientes con CAD.
Introducción
La inflamación manifiesta impulsa la progresión de la enfermedad en las enfermedades crónicas de las vías respiratorias (EAC), como la enfermedad pulmonar obstructiva crónica (EPOC), la fibrosis quística (FQ), el asma grave y las bronquiectasias.1,2,3,4). Uno de los factores que contribuyen a la patogénesis de la EAC es una carga bacteriana elevada en los pulmones en comparación con los individuos sanos, con la presencia de patógenos convencionales como Pseudomonas aeruginosa, Staphylococcus aureus, Haemophilus influenzae, Moraxella catarrhalis y Achromobacter xylosoxidans.5,6,7,8,9,10). Sin embargo, las vías respiratorias de las personas con EAC también albergan otros taxones bacterianos que normalmente no se consideran patógenos respiratorios.7, 11). Se han informado asociaciones entre las características de este microbioma pulmonar de CAD y la gravedad de la enfermedad, incluida la frecuencia de exacerbaciones agudas, el nivel de inflamación de las vías respiratorias y la mortalidad.12,13,14,15,16).
Para obtener más conocimiento sobre el papel de los diferentes miembros del microbioma pulmonar durante la inflamación, previamente aislamos bacterias del esputo de personas con FQ y descubrimos que varios miembros del microbioma podían reducir la inflamación provocada por estímulos proinflamatorios relevantes para la FQ y la EPOC. ya sea solo o en consorcio (17, 18). Además, informes recientes han aclarado que varios miembros del microbioma pulmonar son capaces de suprimir la inflamación inducida por P. aeruginosa (19, 20). Por lo tanto, estos miembros del microbioma pulmonar podrían influir en la progresión de la enfermedad al actuar para suprimir la inflamación de las vías respiratorias.
Si bien el enfoque dependiente del cultivo descrito anteriormente condujo a conocimientos valiosos sobre cómo el microbioma pulmonar podría potencialmente modular la inflamación crónica de las vías respiratorias, se limita al estudio de especies más abundantes y fácilmente cultivables.21, 22). Por lo tanto, los enfoques independientes de la cultura podrían brindar conocimientos complementarios. En el presente estudio, nuestro objetivo fue identificar posibles especies antiinflamatorias comparando el microbioma del esputo entre individuos con EAC con niveles altos o bajos de inflamación de las vías respiratorias. Utilizando este enfoque, identificamos el género Aggregatibacter como más abundante en muestras respiratorias con las concentraciones más bajas de mediadores proinflamatorios en comparación con muestras con los niveles más altos de inflamación. Utilizando un modelo de cultivo de células epiteliales de pulmón tridimensional (3-D) fisiológicamente relevante, demostramos que Aggregatibacter spp. (es decir, A. actinomycetemcomitans, A. aphrophilus) y su sobrenadante libre de células tienen actividad antiinflamatoria in vitro.
Materiales y métodos
Cohortes de estudio
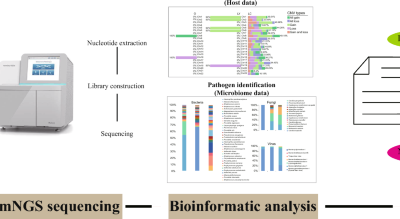
Se disponía de datos emparejados del microbioma del esputo y de los niveles de mediadores inflamatorios para tres cohortes de adultos con CAD: una cohorte australiana de asma grave (denominada Aus-asma), una cohorte australiana de bronquiectasias (denominada Aus-bx) y una cohorte escocesa de bronquiectasias (denominada Scot-bx). . Las cohortes Aus-asthma y Aus-bx se recolectaron como muestras de referencia como parte de un ensayo controlado aleatorio (aprobación ética ACTRN12609000197235, fecha de registro 20/04/2009, por el comité de ética de investigación humana de Hunter New England y ACTRN12608000460303, fecha de registro 14/ 07/2009, por el Servicio de Salud Mater ética en la investigación humana comité, respectivamente) (23, 24). La cohorte Scot-bx, compuesta por pacientes con bronquiectasias clínicamente estables, fue sometida a un estudio observacional prospectivo para asociar las características del microbioma con la gravedad de la enfermedad y los resultados de salud a largo plazo (aprobación ética 12/ES/0059 por el Comité de Ética en Investigación del Este de Escocia) (25). Todos los estudios se realizaron de acuerdo con la Declaración de Helsinki enmendada. Se dispuso de datos coincidentes de microbioma y marcadores inflamatorios para 101, 62 y 105 individuos de las cohortes Aus-asthma, Aus-bx y Scot-bx, respectivamente. Los criterios de inclusión y exclusión, las métricas de los pacientes, junto con la metodología para la recolección de esputo, la cuantificación de marcadores inflamatorios, la extracción de ADN, la secuenciación del amplicón de ARNr 16S y el análisis bioinformático de las tres cohortes se describieron ampliamente en artículos anteriores (18, 23,24,25,26,27). Las diferencias en los protocolos de procesamiento, secuenciación y análisis entre las tres cohortes se enumeran en la tabla complementaria A.
Cepas bacterianas y condiciones de cultivo.
Se utilizaron dos especies bacterianas del género Aggregatibacter (A. actinomycetemcomitans CCUG 56172 y A. aphrophilus CCUG 56235) y P. aeruginosa PAO1 (ATCC15692). Cultivos puros de Aggregratibacter spp. se cultivaron en agar chocolate enriquecido con Vitox (Thermo Fisher Scientific, Waltham, MA, EE. UU.) en condiciones microaeróbicas (3 % O2, 5 % CO2 y 92 % N2) en una cámara de hipoxia (Bactrox; Sheldon Manufacturing Inc.) a 37 ° C durante 24 h. P. aeruginosa PAO1 se sembró en placas de agar Luria Bertani (LB) (Neogen, Lansing, MI, EE. UU.) y se incubó durante 24 h a 37 °C en condiciones normóxicas (es decir, aire ambiente). Se realizaron cultivos líquidos durante la noche de todas las especies en caldo Brain Heart Infusion (BHIB) (Neogen) y se cultivaron a 37 °C en agitación constante (250 rpm) hasta alcanzar la fase estacionaria. Aggregatibacter spp. se cultivaron en condiciones microaeróbicas (<1% O2) (Oxoid CampyGen Compact Sachet; Thermo Fisher Scientific), y P. aeruginosa PAO1 se cultivó en condiciones normóxicas.
Modelo tridimensional de cultivo de células epiteliales de pulmón.
Se utilizó un modelo de cultivo de células pulmonares tridimensionales organotípicos desarrollado previamente de la línea celular epitelial alveolar A549 (ATCC CCL185) o la línea celular estable recombinante A549 transfectada con NF-κB-luciferasa (BPS Bioscience, San Diego, CA, EE. UU.) que exhibe propiedades fenotípicas y funcionales similares a las in vivo de las células epiteliales alveolares, incluida la función de barrera (expresión localizada de marcadores de unión), polaridad apical y basolateral, y responde a la infección de maneras que son relevantes para el proceso de infección in vivo, incluida la secreción de citocinas (18, 28,29,30). Si bien la línea celular A549 se deriva de un adenocarcinoma y carece de muchas características in vivo cuando se cultiva como monocapas 2-D, cuando se cultivan en 3-D estas células regulan negativamente los marcadores específicos del cáncer (panqueratina, citoqueratina 7 y vimentina).29). Brevemente, el modelo de cultivo celular tridimensional se generó cultivando monocapas de cualquiera de las líneas celulares en matraces T75 a 37 °C, 5 % de CO2. Las células se cultivaron en medio GTSF-2 (HyClone, Logan, UT, EE. UU.) suplementado con 1,5 g/l de bicarbonato de sodio (Sigma-Aldrich), suero bovino fetal (FBS) al 10 % (Life Technologies, Carlsbad, CA, EE. UU.) 2,5 mg/L de insulina transferrina selenito sódico (Lonza, Basilea, Suiza) y penicilina-estreptomicina al 1% (Sigma-Aldrich). Cuando se alcanzó la confluencia, se transfirieron 2 × 106 células viables a un biorreactor de recipiente de pared giratoria (RWV) junto con 0,25 g de perlas de microportador recubiertas con colágeno I (perlas de microportador Cytodex-3, Sigma-Aldrich) y se cultivaron durante 11 a 14 días con cambio de medio los días 6 y 8. Después de 11 días, el medio celular se cambió a medio GTSF-2 sin FBS ni antibióticos. Para los experimentos de interacción huésped-microbio, se transfirieron 2,5 x 105 células/pocillo en medio GTSF-2 sin FBS ni antibióticos a una placa de 96 pocillos.
Estudios de interacción huésped-microbio in vitro.
Los cultivos bacterianos se centrifugaron (5000 rpm, 8 min) y se resuspendieron en GTSF-2 sin FBS antes de ponerlos en contacto con las células huésped. Para experimentos con sobrenadante libre de células de Aggregatibacter spp., los cultivos se centrifugaron y posteriormente se filtraron (0,22 μm). A continuación, se incubaron células tridimensionales con Aggregatibacter spp. a diversas multiplicidades de infección dirigidas (MOI) que van desde MOI 50 a MOI 0,78 o 100 µl de sobrenadante libre de células (en un volumen total de 250 µl), en presencia o ausencia de estímulos proinflamatorios (100 µg/ml de lipopolisacárido ( LPS) (Sigma-Aldrich) o P. aeruginosa PAO1 en una MOI 10). A continuación, los cultivos se incubaron en condiciones microaeróbicas (3% O2, 5% CO2 y 92% N2) en una cámara de hipoxia (Bactrox; Sheldon Manufacturing Inc.) durante 4 h a 37 °C. Después de la incubación, se evaluaron la activación de la vía NF-κB, la medición de citoquinas, la citotoxicidad y la asociación bacteriana con las células epiteliales como se describe a continuación.
Ensayo de luciferasa NF-κB
Se incubaron células A549 transfectadas con luciferasa 3-D NF-κB con Aggregatibacter spp. o su sobrenadante libre de células y/o estímulos proinflamatorios (LPS o P. aeruginosa PAO1) durante 4 h. Posteriormente, se utilizó el sistema de ensayo de luciferasa One-Step (BPS Bioscience) para determinar la activación de la vía NF-κB, de acuerdo con…