Resumen
Investigamos los efectos de la glicerina vegetal (VG), un componente principal de los cigarrillos electrónicos, sobre la lesión pulmonar aguda (ALI) inducida por endotoxinas. Los ratones recibieron administración intratraqueal de VG al 30 % en vehículo de solución salina tamponada con fosfato (PBS) o solo PBS (control) durante 4 días. El día 5, los ratones recibieron una instilación intratraqueal de lipopolisacárido (LPS) (grupo LPS y grupo VG + LPS) o PBS (grupo VG y grupo control). La histopatología pulmonar, la expresión de receptores de quimioquinas y la señalización reguladora se analizaron 24 h después del tratamiento del Día 5. VG aumentó significativamente los cambios histopatológicos y fibróticos asociados con ALI tanto en el grupo VG como en los ratones ALI inducidos por LPS (grupo VG + LPS). Los análisis de inmunohistoquímica (IHC) y western blot revelaron que la administración de VG resultó en una regulación positiva de los marcadores de neutrófilos. [lymphocyte antigen 6 complex locus G6D (Ly6G) and myeloperoxidase (MPO)] así como la regulación al alza de la expresión del factor de crecimiento transformante-β (TGF-β), un mediador central de la fibrogénesis, en los pulmones de los grupos VG y VG + LPS. VG mejoró la expresión de moléculas de adhesión. [very late antigen 4 (VLA-4) and vascular cell adhesion molecule 1 (VCAM-1)] y una mayor activación de la proteína quinasa activada por mitógeno p38 (p38 MAPK) para impulsar el reclutamiento de neutrófilos en los pulmones de ratones con ALI. La administración intraperitoneal de un inhibidor de p38 atenuó significativamente estos cambios histopatológicos, así como la regulación positiva inducida por VG en la expresión de Ly6G, MPO, VLA-4, VCAM-1, TGF-β y colágeno-1 en ratones con ALI. En conclusión, VG mejora la quimiotaxis de neutrófilos y la fibrosis y amplifica la respuesta inflamatoria asociada con ALI inducida por LPS en los pulmones a través de la mejora de la actividad de p38 MAPK.
Introducción
La lesión pulmonar asociada al uso de cigarrillos electrónicos/productos de vapeo (EVALI, por sus siglas en inglés), originalmente conocida como enfermedad pulmonar asociada al vapeo, es una enfermedad respiratoria aguda o subaguda que puede ser crítica y fatal. Un grupo de pacientes con una misteriosa enfermedad pulmonar, que ahora se reconoce como EVALI, se describió por primera vez en julio de 2019 en los EE. UU. [1]. Hasta el 18 de febrero de 2020, los Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU. habían documentado 2807 casos de EVALI, incluidos 68 que fueron fatales [2], y citaron el vapeo como la causa principal. Las sustancias vapeadas en los cigarrillos electrónicos contienen muchas sustancias, incluidos aditivos como glicerina vegetal (VG) y propilenglicol (PG), así como ingredientes aromatizantes, nicotina, cannabinoides (p. ej., tetrahidrocannabinol, cannabidiol) y acetato de vitamina E. Al calentarse, VG y PG generan vapor y actúan como portadores de nicotina y saborizantes.
El factor de riesgo clave para EVALI es el uso de cigarrillos electrónicos o productos similares. Sin embargo, la patogenia de EVALI aún no está clara. Se han informado muchos hallazgos patológicos diferentes relacionados con EVALI, que incluyen lesión pulmonar aguda (ALI), daño alveolar difuso, hemorragia alveolar difusa, neumonía organizada, neumonía eosinofílica aguda, neumonía lipoidea y bronquiolitis respiratoria, enfermedad pulmonar intersticial. [3]. Aunque los hallazgos patológicos precisos de EVALI pueden ser diversos, existe cierta evidencia consistente que merece atención. El CDC informó que las personas que usan productos de vapeo que contienen cannabinoides tienen un mayor riesgo de desarrollar síndrome de dificultad respiratoria aguda grave (SDRA) secundario a EVALI. La evidencia reciente ha implicado al acetato de vitamina E en los cigarrillos electrónicos como un impulsor del desarrollo de SDRA grave en pacientes con EVALI [4]. Sin embargo, el enfoque en los compuestos de los cigarrillos electrónicos como instigadores químicos del brote de EVALI es razonable. Se ha demostrado que los líquidos de los cigarrillos electrónicos contienen muchos compuestos tóxicos: nicotina, compuestos orgánicos volátiles, trazas de metales, endotoxinas bacterianas y glucanos fúngicos. Estudios experimentales adicionales pueden proporcionar información sobre si la exposición a otros componentes de los cigarrillos electrónicos puede causar directamente una lesión pulmonar [5]. VG se usa generalmente para la producción de aerosoles cuando se vaporiza. Sin embargo, la seguridad del uso de VG sigue sin estar clara en el contexto de los crecientes informes de inflamación pulmonar en muchos usuarios de cigarrillos electrónicos. Se requiere la investigación sobre los efectos del vapeo en la biología pulmonar para establecer una guía y regulación clara de política pública [6].
ALI y ARDS son enfermedades potencialmente mortales en pacientes críticamente enfermos. La comorbilidad ALI/ARDS se caracteriza por el reclutamiento de neutrófilos en los pulmones, edema intersticial, lesión endotelial y lesión epitelial. La causa más común de ALI/ARDS es la sepsis grave y el shock séptico causado por una infección bacteriana. El lipopolisacárido (LPS) es una endotoxina de los bacilos gramnegativos que actúa como un fuerte componente quimiotáctico para los neutrófilos y, por lo tanto, es un fuerte desencadenante de la patogenia de la sepsis y el shock séptico. [7]. Los neutrófilos, las células inflamatorias que responden antes a la sepsis, se reclutan después de un estímulo inflamatorio en la ALI inducida por sepsis. Nuestro trabajo anterior [8,9,10,11,12,13] ha demostrado que una inyección intratraqueal de LPS promueve la migración de neutrófilos que da como resultado una ALI extensa en ratones. Sin embargo, el papel de la VG en la ALI inducida por sepsis no se comprende por completo. En el presente informe, describimos nuestra investigación sobre los efectos de VG en la quimiotaxis de neutrófilos en un modelo de ratón de ALI inducida por endotoxinas.
Resultados
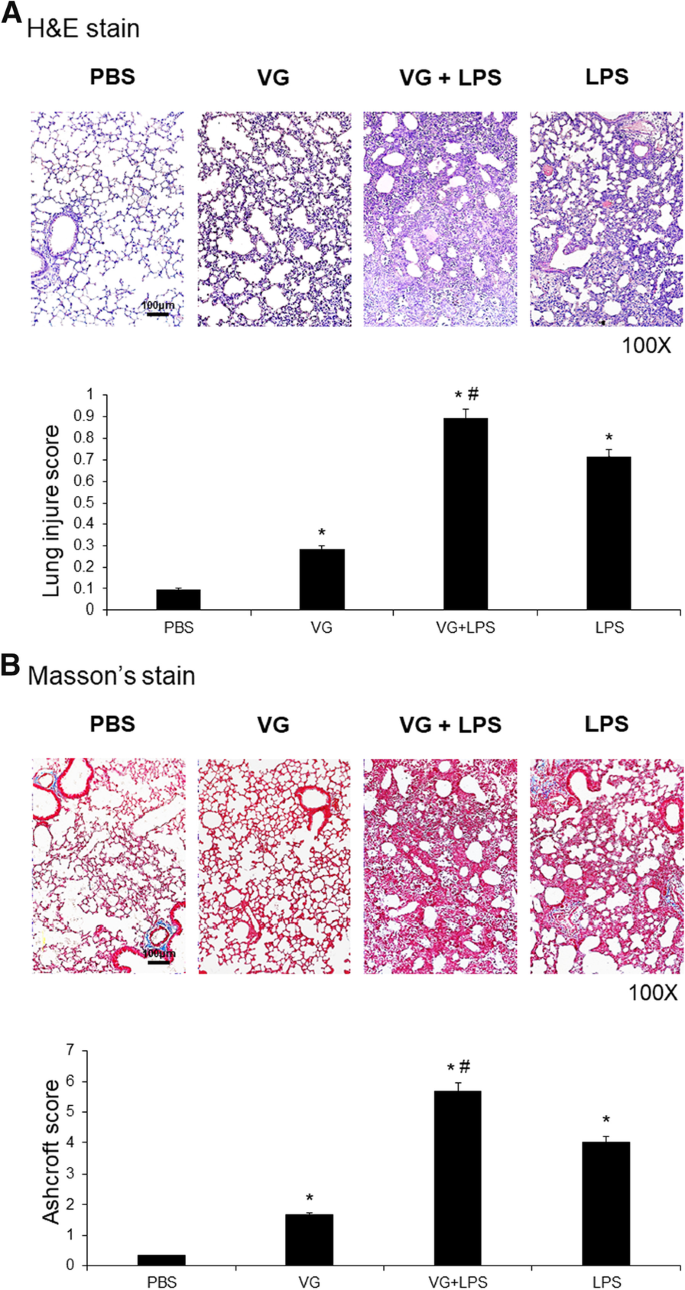
Efectos de VG en las características histopatológicas de ALI inducida por LPS
El examen de secciones de pulmón teñidas con hematoxilina y eosina (H&E) de ratones que recibieron una inyección intratraqueal de LPS reveló ALI caracterizado por edema alveolar con reclutamiento de neutrófilos (Fig. 1A). La administración intratraqueal de VG indujo una respuesta inflamatoria aguda que condujo a ALI leve en ratones. Significativamente, los ratones que habían recibido VG mostraron cambios patológicos mejorados en sus pulmones al ser sometidos a ALI inducido por LPS (Fig. 1A). La puntuación de Ashcroft de las muestras de tejido pulmonar teñidas con tricrómico de Masson reveló que se indujo una fibrosis pulmonar sustancial en todos los ratones ALI inyectados con LPS. Los ratones que recibieron VG sin una inyección de LPS habían aumentado significativamente la fibrosis pulmonar en relación con los controles del vehículo inyectados solo con solución salina tamponada con fosfato (PBS). Los ratones que recibieron VG antes de la inyección de LPS exhibieron una fibrosis pulmonar dramáticamente más severa que los ratones ALI inducidos por LPS no expuestos a VG (Fig. 1B).
Examen histológico de lesión pulmonar inducida por VG. La administración de VG, un componente principal del cigarrillo electrónico, mejoró las características histológicas en ratones con ALI inducida por LPS. A El examen histológico de las secciones teñidas con H&E reveló que los pulmones de los ratones inyectados con PBS (grupo de control no tratado), VG (grupo VG solo), LPS (grupo solo LPS) y VG antes de LPS (grupo VG + LPS) tenían anomalías histopatológicas mínimas, ALI leve, ALI pronunciado y ALI grave, respectivamente, lo que demuestra que la VG intratraqueal amplificó la patología de la lesión pulmonar en ratones con ALI inducida por LPS. B La puntuación de lesiones pulmonares de Ashcroft de las secciones teñidas con tricrómico de Masson también mostró que VG indujo fibrosis pulmonar en ratones no expuestos a LPS y exacerbó la fibrosis pulmonar en ratones con ALI inducido por LPS. Los conjuntos de datos se expresan como medias ± desviaciones estándar. *p < 0,05 frente a PBS, #p < 0,05 frente a LPS; N = 6 por grupo
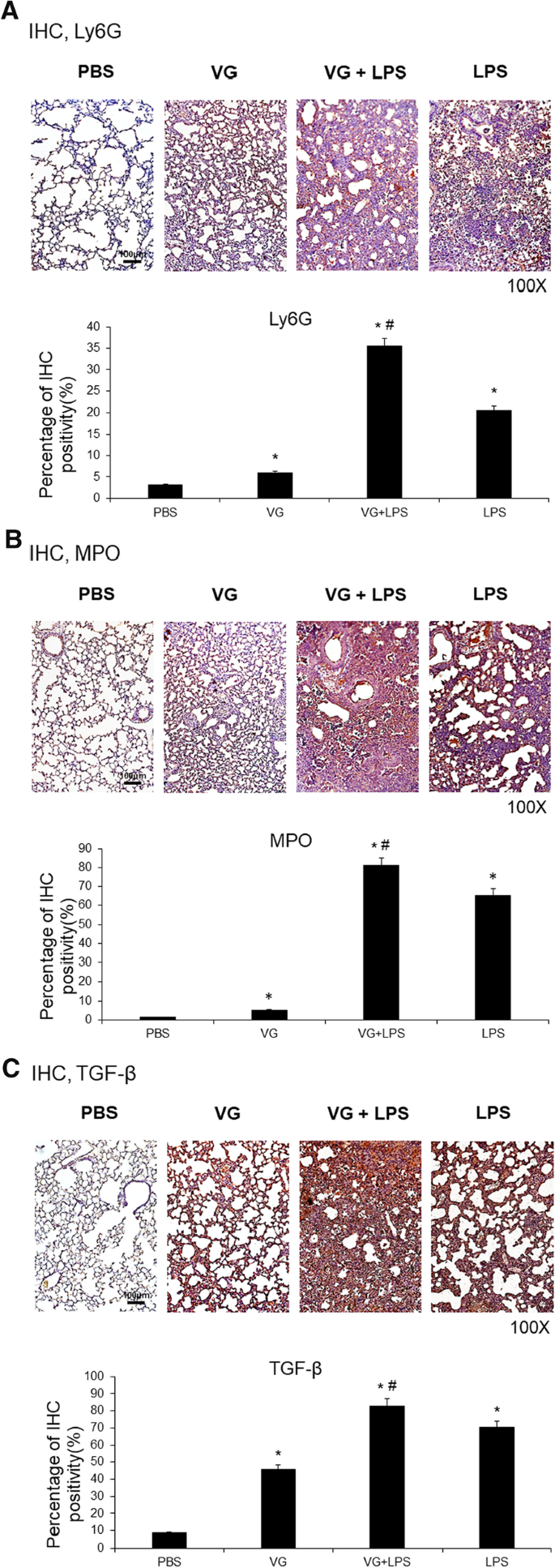
Efectos de VG sobre la acumulación de neutrófilos y la fibrogénesis en los pulmones
Marcaje inmunohistoquímico (IHC) de los marcadores comunes de neutrófilos linfocito antígeno 6 complejo locus G6D (Ly6G) y mieloperoxidasa (MPO) (Fig. 2A y B) mostró que, en comparación con los ratones de control, los ratones inyectados con VG tenían un reclutamiento de neutrófilos ligeramente mayor en sus pulmones (Ly6G, 3,2 % frente a 6,0 %; MPO, 1,3 % frente a 5,2 %; ambos pag< 0,05), mientras que los ratones ALI inducidos por LPS tenían una marcada acumulación de neutrófilos en sus pulmones (Ly6G, 20,6 %; MPO, 65,4 %; ambos pag<0,05). La administración de VG aumentó la acumulación de neutrófilos en los pulmones de ratones ALI inducidos por LPS (VG + LPS: Ly6G, 35,5 %; MPO, 81,2 %; ambos pag<0,05).