Resumen
Mycobacterium tuberculosis (M. TB) es un patógeno intracelular adeptos para evadir el sistema inmune humano a través de una variedad de mecanismos. Durante la infección, M. TB secreta numerosos factores de virulencia, incluido el objetivo de antígeno secretor temprano de 6 kDa (ESAT-6), que es producido por el sistema de secreción ESX-1. ESAT-6 juega un papel crucial en las interacciones huésped-patógeno, ya sea independientemente o en asociación con la proteína de filtrado de cultivo 10 (CFP-10). Si bien algunas investigaciones han investigado el papel de ESAT-6 en la patogenicidad de M. TB y el desarrollo de la vacuna, su contribución precisa a la evasión inmune y los mecanismos celulares involucrados siguen siendo poco conocidos. Para abordar esto, utilizamos macrófagos THP-1 (A) cultivados para caracterizar los efectos del ESAT-6 secretado en las defensas del huésped celular y la apoptosis. Encontramos que ESAT-6 (5 μg/ml) inhibió la apoptosis inducida por M. Tb en los macrófagos THP-1 (A) suprimiendo el receptor 2 (TLR2) de Toll (TLR2) a través de la vía caspasa-9/caspasa-3. Además, ESAT-6 redujo la fagocitosis de M. Tb por los macrófagos THP-1 (A) al regular negativamente la producción de interleucina-10 (IL-10), factor de necrosis tumoral alfa (TNF-α) e interleucina-12 (IL-12). Además, ESAT-6 disminuyó la actividad bactericida de los macrófagos al inducir la producción de especies reactivas de oxígeno (ROS). Paralelamente, nuestro análisis in silico de genes expresados diferencialmente en células dendríticas (DC) infectadas con cepas de Bacille Calmette-Guérin (BCG), con o sin la región de diferencia de diferencia-1 (RD1), se sugiere fuertemente que ESAT-6, ubicado dentro de la región RD1, modula las funciones de defensa de la defensa y apoptosis en DCS durante BCGG. Colectivamente, estos hallazgos indican que ESAT-6 juega un papel fundamental en la modulación de la respuesta inmune innata de los macrófagos contra M. TB regulando el reconocimiento de macrófagos, la fagocitosis, la actividad bactericida y la apoptosis. Nuestro estudio proporciona información valiosa sobre posibles objetivos moleculares para el desarrollo de vacunas innovadoras y estrategias terapéuticas contra M. TB.
Introducción
La tuberculosis (TB) sigue siendo un desafío de salud global significativo, contribuyendo sustancialmente a la enfermedad y la mortalidad en todo el mundo (1). En 2007, la TB superó al síndrome de inmunodeficiencia adquirida (SIDA) como la principal causa de muerte por enfermedades infecciosas. Las estadísticas actuales indican que esta enfermedad prevenible y curable aún afecta a más de 10 millones de personas cada año. La pandemia Covid-19 ha exacerbado aún más la situación, revertiendo años de progreso en la lucha contra la TB. En 2022, 7,5 millones de personas fueron diagnosticadas recientemente con TB, lo que causa casi el doble de muertes que el VIH/SIDA (1, 2). Actualmente, las estrategias principales para combatir la TB se limitan a los tratamientos de antibióticos, mientras que no ha habido avance en el desarrollo de nuevas vacunas de TB durante muchos años. La falta de protección efectiva de base inmune subraya la necesidad urgente de una mayor investigación sobre los mecanismos de virulencia de M. TB, la fisiopatología de la enfermedad y la creación de vacunas innovadoras para combatir la TB (3).
El objetivo de antígeno secretorio temprano de 6 kDa (ESAT-6) es una proteína virulenta secretada por el sistema único de secreción de secreción de tipo VII ESX-1 dentro de la región de diferencia-1 (RD1) grupo de genes de M. Tb (4). En particular, el ESAT-6, junto con su proteína de filtrado de cultivo de proteínas socio (CFP-10) (RV3874 y RV3875), es secretada por la cepa H37RV altamente virulenta (Fig. 1) pero no por la cepa H37RA atenuada. Los primeros estudios han destacado el papel significativo de ESAT-6 en la patogénesis de M. Tb (5). Curiosamente, la restauración de la secreción de ESAT-6 en la cepa de la vacuna Bacillus Calmette-Guelin (BCG) mejoró la inmunogenicidad de BCG pero también aumentó su virulencia (6). Estos hallazgos nos llevaron a plantear la hipótesis de que ESAT-6 juega un papel crítico en la evasión de la inmunidad del huésped por M. TB.
Fig. 1Ubicación genómica de ESAT6 en la región RD1 de M. TB (RV3616C y RV3684). La parte sombreada gris es la región RD1
Imagen de tamaño completoLos receptores tipo toll (TLR) son componentes esenciales del sistema inmune innato, que juegan un papel fundamental en la respuesta inflamatoria a los patógenos invasores. En el contexto de la infección por M. TB, numerosos estudios han demostrado que el receptor 2 de Toll (TLR2) (7,8,9) y el receptor 4 (TLR4) (TLR4) (8,9,10) son cruciales para el reconocimiento de M. Tb y el inicio de la respuesta de defensa inflamatoria (11, 12). Como defensores de la primera línea, los macrófagos pueden fagocitar M. TB, lo que lleva a la inhibición o asesinato del patógeno, un proceso que está al menos parcialmente mediado por la activación de TLR. Sin embargo, M. TB ha evolucionado varias estrategias para evadir las respuestas microbicidas de los macrófagos. Estas estrategias incluyen inhibir la maduración del fagosomas (13), modulando la producción de citocinas pro y antiinflamatorias (14, 15) y suprimir la apoptosis (16). Entre estos, la supresión de la apoptosis a través de TLRS (17) es una estrategia clave empleada por cepas virulentas de M. TB. A diferencia de la necrosis, que puede provocar proliferación bacteriana, diseminación, inflamación local y daño tisular (18), la apoptosis juega un papel protector al promover la presentación de antígeno y restringir la liberación de bacterias intracelulares (19), mejorando así la defensa inmune del anfitrión.
Durante la infección por M. TB, la apoptosis inducida por patógenos en los macrófagos es crucial para controlar la infección, ya que activa las respuestas inmunes innatas y adaptativas a través de vías moleculares distintas (20, 21). Sin embargo, las cepas virulentas de M. TB suprimen la apoptosis en los macrófagos del huésped, lo que permite que las bacterias sobrevivan y se replicen dentro de las células huésped. Dado este contexto, es esencial investigar si la proteína virulenta ESAT-6 secretada interfiere con la apoptosis de los macrófagos y dilucidar los mecanismos moleculares precisos involucrados.
Se emplearon herramientas de análisis de biología bioinformática y celular para investigar la participación de ESAT-6 en los mecanismos de evasión inmune de M. TB. El impacto funcional de ESAT-6 en la defensa de las células huésped y la apoptosis se caracterizó utilizando experimentos in vitro con macrófagos THP-1 (A). Nuestros hallazgos revelaron que ESAT-6, a una concentración óptima de 5 μg/ml, inhibió la apoptosis inducida por H37RA en los macrófagos THP-1 (A) a través de las vías caspasa-3/caspasa-9 mediadas por TLR2. Además, ESAT-6 moduló la defensa inmune de los macrófagos contra M. Tb al inhibir la producción de citocinas clave, incluida la interleucina-10 (IL-10), la interleucina-12 (IL-12) y el factor de necrosis tumoral (TNF-α). Para validar estos resultados, nuestros análisis in silico confirmaron que la región RD1, que incluye el gen ESAT-6, regula diferencialmente los genes del huésped involucrados en las vías de tuberculosis y apoptosis (Figs. Suplementarias S1, S2). Este estudio buscó confirmar el papel de ESAT-6 en la evasión de M. TB de respuestas inmunes mediadas por macrófagos.
Nuestra investigación aclara los mecanismos moleculares por los cuales M. TB evade respuestas inmunes del huésped, particularmente en el contexto de la inmunidad innata mediada por macrófagos. Estas ideas podrían mejorar la comprensión teórica de la patogénesis de la tuberculosis y contribuir al desarrollo de intervenciones terapéuticas innovadoras y vacunas más efectivas para los pacientes con TB.
Resultados
ESAT-6 inhibe la apoptosis de los macrófagos THP-1 (A) a través de TLR2
Se ha demostrado que las cepas atenuadas de M. Tb inducen niveles más altos de apoptosis en los macrófagos alveolares en comparación con sus contrapartes virulentas (22). ESAT-6, una proteína secretada por la cepa H37RV virulenta, está notablemente ausente en el perfil de secreción de la cepa H37RA atenuada (23). Investigamos los efectos de ESAT-6 y H37RA sobre la apoptosis en células THP-1 (A) usando citometría de flujo. Nuestros resultados mostraron que la infección de M. TB aumentó significativamente la apoptosis en las células THP-1 (A) en comparación con el grupo de control no tratado (Fig. 2A). Sin embargo, cuando se añadió ESAT-6 (5 μg/ml) a las células infectadas, este aumento en la apoptosis se invirtió notablemente (Fig. 2A). Curiosamente, una mayor concentración de ESAT-6 (10 μg/ml) dio como resultado una velocidad apoptótica más alta que la dosis de 5 μg/ml, lo que sugiere una posible toxicidad celular a niveles elevados de ESAT-6 (Fig. 2B). También confirmamos que ESAT-6 no causa citotoxicidad en este rango de concentración (Fig. Suplementaria S3), mientras que puede inducir ligeramente la apoptosis sin el desafío M. TB (Figura complementaria S4). La infección por TB también causó disfunción mitocondrial, como lo demuestra una disminución en el potencial de la membrana mitocondrial, un marcador clave de apoptosis (Fig. 2DO). La adición de ESAT-6 exógeno mitigó significativamente esta reducción en el potencial de membrana mitocondrial (Fig. 2D). Para confirmar que ESAT-6 inhibe la apoptosis a través de TLR2, utilizamos el anticuerpo selectivo de bloqueo TLR2 AB9100. El tratamiento con AB9100 invirtió significativamente el efecto antiapoptótico de ESAT-6 en comparación con el grupo ESAT-6 sin el anticuerpo (Fig. 3A, B). Mientras que AB9100 no alteró la apoptosis modulada por M. TB sin ESAT-6 (Fig. Suplementaria S5). Estos hallazgos confirman que ESAT-6 inhibe la apoptosis de los macrófagos a través de la vía TLR2.
Fig. 2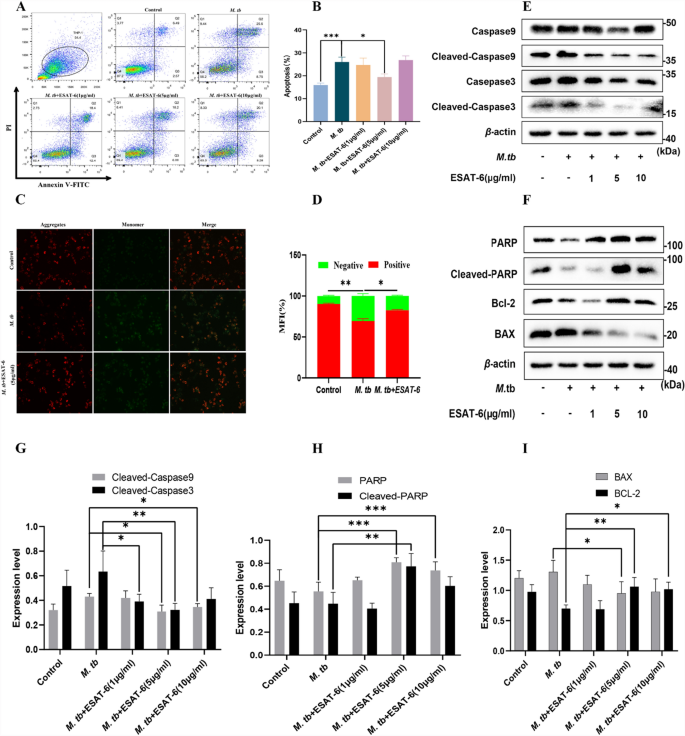
La proteína ESAT-6 recombinante inhibe la apoptosis inducida por TB de THP-1 (A) a través de la caspasa 9/caspasa 3. A Los efectos de M. TB y ESAT-6 en los macrófagos. La apoptosis celular se evaluó por citometría de flujo. Las células THP-1 (a) (1 × 106) se incubaron con M. Tb o/y diferentes concentraciones de ESAT-6 durante 24 h. La respuesta dependiente de la dosis de East-6 en la apoptosis de los macrófagos fue detectada por el método de anexina V FITC/PI. B Se muestran datos cuantitativos de apoptosis en los macrófagos estimulados por ESAT-6 y/o micobacterias. do Las células THP-1 (a) (1 × 106) se incubaron con M. Tb o/y diferentes concentraciones de ESAT-6 durante 24 h. Las células recibieron ESAT-6 y M. TB se tiñeron con JC-1 para la medición del potencial de membrana mitocondrial. Se observó una imagen grupal representativa de células teñidas bajo un microscopio de fluorescencia invertido. D Datos cuantitativos de MFI en ESAT-6 …
(Tagstotranslate) ESAT-6 (T) Apoptosis (T) TLR2 (T) Macrófago (T) N M. Tb n (T) Sistema de neumología/respiratorio