Resumen
Antecedentes
El humo pasivo tiene un impacto significativo en la función pulmonar y constituye un problema crítico de salud pública, ya que fumar genera radicales libres que dañan los pulmones y otros tejidos. Actualmente, existe una investigación limitada sobre si la melatonina, un antioxidante, puede mitigar el daño pulmonar causado por fumar. Este estudio tiene como objetivo investigar los mecanismos mediante los cuales la melatonina alivia la enfermedad pulmonar aguda inducida por el tabaquismo pasivo.
Métodos
Las ratas se dividieron en cinco grupos (n = 6): un grupo de control y tres grupos expuestos a concentraciones bajas, medias y altas de humo, y un grupo de tratamiento con melatonina.
Resultados
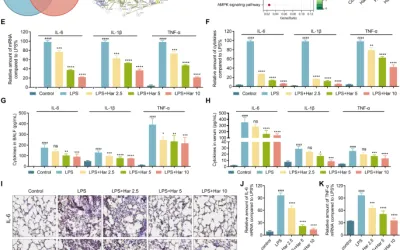
Los datos indicaron que en el grupo de fumadores pasivos de alta concentración, la estructura alveolar del tejido pulmonar se destruyó y la capacidad antioxidante total en el tejido pulmonar disminuyó a medida que aumentaba la concentración de humo. Las expresiones de TNF-α, IL-6 e IL-1β mostraron resultados similares. El nivel de ARNm de los factores antiapoptóticos Bcl-2 y Bcl-xL disminuyó significativamente en el grupo de fumadores de alta concentración, mientras que no se observaron cambios significativos en los grupos de concentración media y baja. Por el contrario, el tabaquismo pasivo de alta concentración aumentó los niveles de ARNm de los factores proapoptóticos Bax y Caspasa-3. Además, los niveles de melatonina endógena en el tejido pulmonar disminuyeron gradualmente después de la exposición al humo, mientras que la melatonina exógena alivió los cambios en los factores inflamatorios y los factores relacionados con la apoptosis en el tejido pulmonar. Además, en altas concentraciones de tabaco, los niveles de ARNm de los genes relacionados con el cáncer de pulmón, el factor de crecimiento endotelial vascular (VEGF), citocromoP450 1A1 (CYP1A1), y el citocromo P450 1B1 (CYP1B1) aumentaron significativamente, mientras que la melatonina exógena redujo la expresión de estos genes en el tejido pulmonar.
Conclusiones
Estos hallazgos sugieren que la melatonina puede disminuir el daño del tejido pulmonar, la apoptosis y las respuestas inflamatorias inducidas por el tabaquismo pasivo, así como disminuir la expresión de genes relacionados con el cáncer de pulmón. Se necesitarán más investigaciones experimentales que involucren tratamientos con melatonina exógena.
Introducción
Como sabemos, en muchos países la gente pasa la mayor parte del tiempo en interiores, por lo que un ambiente interior limpio es importante para la salud humana. El humo del tabaco ambiental es conocido como una fuente importante de múltiples contaminantes, especialmente en ambientes interiores (1). El humo del tabaco es similar a otros contaminantes procedentes de la combustión; tiene un efecto directo sobre las partículas PM2,5 en interiores. Los estudios han demostrado que las PM2,5 están estrechamente relacionadas con las enfermedades pulmonares crónicas (2). De hecho, los residuos del humo del tabaco pueden permanecer en el aire o ser absorbidos por las superficies de la habitación y convertirse en una fuente de exposición prolongada a contaminantes nocivos incluso cuando se ha dejado de fumar. Ni resumió sistemáticamente la relación entre el tabaquismo y las PM2.5 en interiores y el mecanismo que sustenta el vínculo entre el humo del tabaco, las PM2.5 y las enfermedades pulmonares crónicas (3).
humo de cigarrillo (CS), una mezcla muy compleja que contiene más de 4.000 compuestos, provoca respuestas celulares aberrantes que provocan daños en los tejidos alrededor de las vías respiratorias y los alvéolos, lo que subyace a diversas enfermedades pulmonares (4). Los ingredientes del humo del cigarrillo pueden dañar el ADN del cuerpo, los compuestos electrofílicos del humo del tabaco se unen a los sitios nucleofílicos de los nucleótidos del ADN y conducen a la formación de aductos de ADN, que causan mutaciones genéticas (5). Además de eso, fumar alteró la diversidad microbiana y las comunidades en el tracto respiratorio inferior de ratones, lo que debería considerarse en futuros estudios centrados en la enfermedad inflamatoria inducida por fumar (6). Además, el CS es el factor de riesgo más importante para la enfermedad pulmonar obstructiva crónica (EPOC) (7). Numerosos estudios han demostrado que la apoptosis de las células epiteliales bronquiales y alveolares provocada por el CS juega un papel clave en la patogénesis de la EPOC.8, 9).
En las personas que fuman, el sistema inmunológico se altera enormemente y se modifica la homeostasis. La exposición al humo del tabaco puede distorsionar las respuestas inmunes al alterar las respuestas de tipo Th1 y aumentar las respuestas dependientes de Th2, principalmente al alterar las funciones inmunes de una variedad de células inmunes y agravar la inflamación y sensibilización alérgicas.10, 11). Las investigaciones han demostrado que la capacidad fagocítica de los macrófagos disminuyó significativamente en fumadores sanos en comparación con los que nunca fumaron (12). Los macrófagos representan más del 90% de las células inmunes alveolares. Los macrófagos clásicamente ejercen efectos reguladores mediante la expresión de citocinas inflamatorias como la interleucina.Illinois)-1, IL-2, IL-4, IL-6, IL-8, factor de necrosis tumoral-α (TNF-α) e interferón gamma (IFN-γ) (13). La inflamación se desencadena cuando el tejido pulmonar está dañado, lo que lleva a un marcado aumento en la expresión de factores inflamatorios como IL-6, INF-γ y TNF-α.13, 14). Se ha demostrado que la exposición al CS eleva los niveles de TNF-α, un mediador clave en la inflamación aguda inducida por el humo y la posterior degradación del tejido conectivo.15). Además, el CS también puede inducir apoptosis en varios tipos de células (16). Por ejemplo, fumar induce la apoptosis de los ovocitos, acelerando el envejecimiento ovárico e induciendo una menopausia más temprana.17). Además, los estudios demostraron que fumar induce factores antiapoptosis que pueden inhibir la apoptosis en las vías tanto dependientes como independientes de caspasa (18). Además de eso, los estudios han demostrado un aumento significativo del cáncer de pulmón causado por fumar. Los miembros de la familia CYP1, incluidos CYP1A1, CYP1A2 y CYP1B1, son inducidos por receptores de aril hidrocarburos (AhRs). Se informa que los ligandos que inducen la expresión de CYP1 son xenobióticos cancerígenos (19). Se descubrió que la exposición al humo del cigarrillo inducía la expresión de las enzimas CYP en los pulmones y el hígado de ratas, lo que, a su vez, aumentaba el estrés oxidativo y la inflamación.20). Los niveles de células inflamatorias y VEGF se correlacionaron positivamente con la cantidad de células cancerosas en el líquido de lavado broncoalveolar (BALF) de pacientes con cáncer de pulmón (21).
En estudios experimentales se ha identificado que la melatonina, sintetizada por la glándula pineal en los mamíferos, así como por órganos no endocrinos como la piel, el intestino y el sistema inmunológico, posee propiedades antioxidantes y antiinflamatorias en condiciones de inflamación exacerbada.22). Al mismo tiempo, numerosos estudios han documentado los efectos protectores de la melatonina sobre el tejido pulmonar (23). Dong et al. investigó los mecanismos moleculares subyacentes a los efectos inhibidores de la melatonina sobre los lipopolisacáridos (lps) inducida por lesión pulmonar aguda en ratas Sprague-Dawley, centrándose en la supresión de la sobreactivación de p38 MAPK (24). Fumar es fácil de inducir la aparición de EPOC, pero He et al. Se observó que la administración de melatonina suprimió significativamente la apoptosis y el estrés del retículo endoplásmico, y aumentó la expresión de SIRT1 en tejidos pulmonares de rata para proteger contra la EPOC (7). Además, el inflamasoma NLRP3 se activa notablemente en los pulmones, lo que lleva a niveles elevados de IL-1β y caspasa-1. Se ha demostrado que la melatonina inhibe la activación del inflamasoma NLRP3, mitigando así la lesión pulmonar aguda.25).
Teniendo en cuenta lo anterior, este estudio investiga el impacto del tabaquismo pasivo en el tejido pulmonar de rata y examina si la melatonina puede mitigar este daño al influir en la expresión de factores inflamatorios y de apoptosis en las células inmunes, o cambiar la expresión de genes asociados al cáncer de pulmón.
Materiales y métodos
animales
Para los experimentos se obtuvieron un total de 30 ratas Sprague-Dawley macho (peso medio: 350 g). Todas las ratas se dividieron aleatoriamente en 5 grupos (n = 6 en cada grupo): Grupo A (grupo de control; las ratas fueron expuestas al aire), Grupo BD (grupo de fumadores; las ratas fueron sometidas a fumar cigarrillos) y Grupo E. (grupo de fumar + melatonina; las ratas fueron sometidas a fumar cigarrillos, inyección de melatonina (50 mg/kg; Sigma-Aldrich, St. Louis, MO, EE. UU.)).
En el experimento de exposición al humo de ratas, se utilizó un aparato modular para fumar suministrado por China Tobacco Jiangsu Industrial Co., LTD. El dispositivo puede fumar automáticamente cuatro cigarrillos a la vez y enviar el humo a la cavidad nasal de la rata a través de una manguera. La marca de cigarrillos utilizada en el estudio fue Marlboro (nicotina 0,5 mg, Philip Morris Companies Inc, EE. UU.). Las ratas del grupo de dosis baja (Grupo B) fueron expuestas a 1 cigarrillo cada vez y quemaron un total de 5 cigarrillos. Las ratas del grupo de dosis media (Grupo C) fueron expuestas a 2 cigarrillos cada vez y quemaron un total de 10 cigarrillos. El grupo de dosis alta (Grupo D/E) estuvo expuesto a 4 cigarrillos cada vez y quemó 20 cigarrillos en total. Las ratas de cada grupo fueron aspiradas durante 1 h sin interrupción. La exposición al cigarrillo durará 7 días. Mientras tanto, a las ratas del grupo E se les administró por vía intraperitoneal 40 mg/kg de melatonina cada día mientras fumaban cigarrillos, mientras que a las del grupo AD se les inyectaron volúmenes equivalentes de solución salina. Los pasos de exposición al humo y la inyección de melatonina se repitieron según los métodos antes mencionados. Al final del día del experimento, los animales fueron anestesiados por vía intraperitoneal con pentobarbital sódico (Sunbiotech, Beijing, China). Finalmente, se extirpó el tejido pulmonar, luego se pesó y se almacenó en temperaturas de paraformaldehído al 4% o nitrógeno líquido hasta su posterior análisis. Todos los procedimientos experimentales fueron aprobados por el comité de ética local para experimentos con animales (Instituto Jinling de Ciencia y Tecnología, Nanjing).
qRT-PCR
El ARN total del tejido pulmonar extraído de rata se extrajo utilizando TRIzol (Invitrogen, Carlsbad, CA, EE. UU.). La concentración y pureza del ARN se midieron utilizando un espectrofotómetro (NanoDrop 2000). Para cada muestra, se tomaron 2 µg del ARN total para la transcripción inversa según las instrucciones del fabricante. Las muestras de ADNc transcritas se almacenaron a -20 °C en un refrigerador.
Prueba de amplificación por PCR brevemente. El sistema de amplificación por PCR contiene 2 µL de ADNc…