Resumen
Antecedentes
El rinovirus humano (HRV), un virus de ARN no envuelto, se identificó por primera vez hace más de 70 años. Es altamente infeccioso y se transmite fácilmente a través de aerosoles y contacto directo. El advenimiento de la PCR multiplex ha mejorado la detección de una amplia gama de virus respiratorios, y el HRV se ubica constantemente entre los patógenos respiratorios más frecuentes a nivel mundial. La circulación ocurre durante todo el año, con una máxima incidencia en otoño y primavera en climas templados. Sorprendentemente, durante la pandemia SARS-CoV-2, la transmisión de HRV persistió, lo que demuestra su resistencia a las estrictas medidas de salud pública destinadas a frenar la transmisión viral.
Cuerpo principal
El HRV se caracteriza por su extensa diversidad genética, que comprende tres especies y más de 170 genotipos. Esta diversidad y un número sustancial de cepas circulantes simultáneamente permiten a los HRV escapar con frecuencia del sistema inmune adaptativo y plantea desafíos formidables para el desarrollo de vacunas efectivas y terapias antivirales. Actualmente hay una falta de tratamientos específicos. Históricamente, el HRV se ha asociado con la infección autolimitada de la respiración superior. Sin embargo, ahora hay evidencia extensa que destaca su papel importante en la enfermedad respiratoria baja severa en adultos, incluidas las exacerbaciones de enfermedades crónicas de las vías respiratorias, como el asma y la enfermedad pulmonar obstructiva crónica (EPOC), así como la neumonía. Estas manifestaciones severas pueden ocurrir incluso en individuos inmunocompetentes, ampliando el impacto clínico de este virus ubicuo. En consecuencia, la carga de las infecciones por rinovirus se extiende a través de varios entornos de atención médica, desde atención primaria hasta salas de hospitales generales y unidades de cuidados intensivos. El impacto del HRV en adultos, en términos de morbilidad y utilización de la salud, rivaliza con el de los otros virus respiratorios importantes, incluidos la influenza y el virus sincitial respiratorio. El reconocimiento de esta carga sustancial subraya la necesidad crítica de nuevas estrategias de tratamiento y protocolos de gestión efectivos para mitigar el impacto de las infecciones por HRV en la salud pública.
Conclusión
Esta revisión examina la epidemiología, las manifestaciones clínicas y los factores de riesgo asociados con la infección grave de HRV en adultos. Al recurrir a la literatura contemporánea, nuestro objetivo es proporcionar una descripción completa de las importantes implicaciones para la salud del virus. Comprender el alcance de este impacto es esencial para desarrollar intervenciones nuevas y específicas y mejorar los resultados de los pacientes frente a este patógeno persistente y adaptable.
Introducción
Desde su identificación inicial por Winston Price en la década de 1950, el rinovirus humano (HRV) se ha reconocido como uno de los agentes más comunes responsables de las infecciones respiratorias (1). Sin embargo, no hay terapias aprobadas para este patógeno. La importancia de la infección por HRV en niños está bien establecida, con asociaciones consistentes encontradas entre las infecciones durante la infancia y el desarrollo de sibilancias, asma y complicaciones respiratorias severas (2). Sin embargo, a pesar de la evidencia que apunta a una morbilidad sustancial en adultos, el impacto de la infección por HRV en esta población sigue subestimado en gran medida. Esta revisión tiene como objetivo arrojar luz sobre este impacto al detallar la epidemiología, la transmisión y las manifestaciones clínicas de HRV. Su objetivo es actualizar a los médicos sobre el papel de la infección por HRV más allá de la infancia, informar los esfuerzos de investigación en curso y subrayar la necesidad urgente de enfoques terapéuticos innovadores.
Fondo
Taxonomía
Los HRV son virus de ARN de sentido positivo y monocatenario que pertenecen al género enterovirus de la familia Picornaviridae (Fig. 1).
Fig. 1Descripción general de la estructura, la taxonomía, la diversidad y los objetivos de infección del rinovirus humano (HRV). El HRV se encuentra entre los patógenos virales más diversos. La vasta diversidad genética de las cepas de HRV circulantes obstaculiza la inmunidad adaptativa, que se limita a cepas homólogas. Por lo tanto, la defensa del huésped depende en gran medida de las respuestas innatas. La co-circulación de estas diversas cepas también presenta un desafío para el desarrollo de terapias antivirales y de vacuna. Abreviaturas: pares de bases de BP, miembro de la familia 3 de cadherina ChDR-3, receptor de lipoproteína de baja densidad ICAM-1, ácido ribonucleico de ARN, proteína viral VP VP
Imagen de tamaño completoLos HRV comprenden tres especies principales, a saber, HRV-A, HRV-B y HRV-C, cada una de las cuales se distingue por características genómicas y secuencias filogenéticas (3,4,5). En particular, el descubrimiento de HRV-C en 2006 se retrasó debido a su incapacidad para cultivarse utilizando técnicas tradicionales (6,7,8).
Genoma y diversidad de HRV
El genoma HRV tiene 7200 pares de bases (BPS) de longitud y consiste en un solo marco de lectura abierto flanqueado por una región no traducida de 5 ‘(UTR) (~ 650 pb) y un 3’ UTR (~ 50 pb). El 5 ‘UTR es crítico para la replicación y la traducción y contiene elementos estructurales y de secuencia esenciales, mientras que el 3’ UTR contribuye a la regulación transcripcional. La proteína traducida se escinde en 11 productos funcionales, incluidas cuatro proteínas virales estructurales (VP), a saber, VP1, VP2, VP3 y VP4, que forman la cápside, y siete proteínas no estructurales involucradas en la replicación y el ensamblaje del genoma (5).
Los HRV exhiben una diversidad notable, principalmente debido a su alta frecuencia de mutación durante la replicación. Inicialmente, los HRV se clasificaron en función de las propiedades antigénicas (serotipado), pero la clasificación actual se basa en el genotipado, utilizando la divergencia en secuencias de nucleótidos de genes de proteínas virales (VP) ((9,10,11,12). Este enfoque de genotipado ha identificado más de 170 genotipos de HRV, que se subdividen en más de 27,000 cepas basadas en diferencias precisas de secuenciación genómica (13).
Además de las mutaciones frecuentes, la recombinación también impulsa la diversidad genética a través de Picornaviridae. Sin embargo, los HRV exhiben tasas de recombinación más bajas que los enterovirus no HRV. La recombinación en HRV se produce predominantemente en la región no traducida 5 ‘(UTR), que es esencial para la replicación y la traducción, y ocasionalmente en las regiones no estructurales (14, 15). Entre las especies de HRV, HRV-A tiene la mayor frecuencia de recombinación. HRV-C se involucra en la recombinación entre especies esporádica con HRV-A en el 5 ‘UTR, contribuyendo a su variabilidad genética, mientras que HRV-B exhibe una actividad de recombinación mínima, con pocos intercambios intergenotípicos documentados (15, 16).
Estructura y replicación de HRV
El HRV no está envuelto, con una cápside icosaédrica compuesta de cuatro proteínas (VP1-4). VPS 1–3 forma la superficie externa de la cápside, que posee propiedades antigénicas, mientras que VP4 se encuentra en la superficie interna y está en contacto directo con el genoma viral (3, 17).
La molécula de adhesión intracelular 1 (ICAM-1) es el receptor viral para todos los tipos de HRV-B y la mayoría de los tipos HRV-A (conocidos como el principal grupo HRV-A) (3, 18). Doce tipos de HRV-A se unen a los receptores de lipoproteínas de baja densidad (LDL-RS), conocido como el grupo menor de HRV-A (19). El miembro de la familia 3 (CHDR-3) relacionado con la cadherina actúa como el receptor viral de la glucoproteína para HRV-C (3, 20).
Al unirse a sus respectivos receptores, el HRV ingresa a las células epiteliales de las vías respiratorias mediante endocitosis y micropinocitosis. El pH intracelular más ácido desencadena la falta de recubrimiento de la cápside, facilitando la traducción del ARN viral de sentido positivo. Los viriones recién formados empaquetados con ARN se ensamblan y luego se liberan de la célula huésped para continuar el ciclo de infección (21,22,23).
Respuesta inmune del huésped al HRV
Upon infection, pathogen-associated molecular patterns (PAMPs) present on HRV, such as elements of the HRV capsid and HRV-RNA, engage host pattern recognition receptors (PRRs), including Toll-like receptors (TLRs), retinoic acid inducible gene-1 (RIG-1) and melanoma differentiation associated gene 5 (MDA-5) (24). RIG-1 y MDA-5 juegan roles cruciales en la defensa del huésped contra los virus de ARN al reconocer el ARN de HRV, lo que lleva a la inducción de una respuesta de interferón tipo I/III (IFN) y la producción de citocinas y quimiocinas proinflamatorias. El posterior reclutamiento de células inmunes innatas, como neutrófilos, macrófagos y células dendríticas, precede a la movilización más lenta de la respuesta inmune adaptativa. El equilibrio entre las señales proinflamatorias y antiinflamatorias determina la gravedad de la respuesta del huésped, en última instancia, influyendo en los resultados clínicos. Si bien la infección por HRV en sí misma tiene efectos citopáticos directos limitados, los IFNS, junto con la quimioterapia/citocinas proinflamatorias, como Rantes, ENA-78 IP-10, IL-6 e IL-8, son responsables del desarrollo de síntomas y citotoxicidad (24,25,26,27,28,29,30). Por ejemplo, el nivel de IL-8 en el líquido nasal se correlaciona con la gravedad de los síntomas nasales, alcanzando un máximo 48-72 h después de la infección (26).
La pandemia SARS-Cov-2 ha subrayado la importancia de una comprensión sofisticada de las interacciones huéspedes-patógenos para identificar factores asociados con la gravedad y las posibles terapias dirigidas al huésped (31,32,33). Se necesitan enfoques transcriptómicos destinados a identificar los factores del huésped asociados con la gravedad en las cohortes de HRV con resultados severos y pueden revelar objetivos potenciales para nuevas terapias moduladoras de huéspedes (34,35,36). Además, los modelos experimentales humanos serán clave para comprender aún más la inmunología del HRV, así como otras infecciones virales respiratorias (RVI) (37, 38). Una revisión reciente destacó las citocinas proinflamatorias clave involucradas en la infección por HRV, incluidas IL-1, IL-4, IL-5, IL-6, IL-25 e IL-33 (39), lo que sugiere su potencial como objetivos viables para los inhibidores de citocinas para mitigar la respuesta inflamatoria inducida por el HRV.
Transmisión de HRV
La transmisión de HRV ocurre a través de rutas en el aire que involucran gotas y aerosoles, así como por contacto a través de la autoinoculación de la mucosa nasal o conjuntival (Fig. 2).
Fig. 2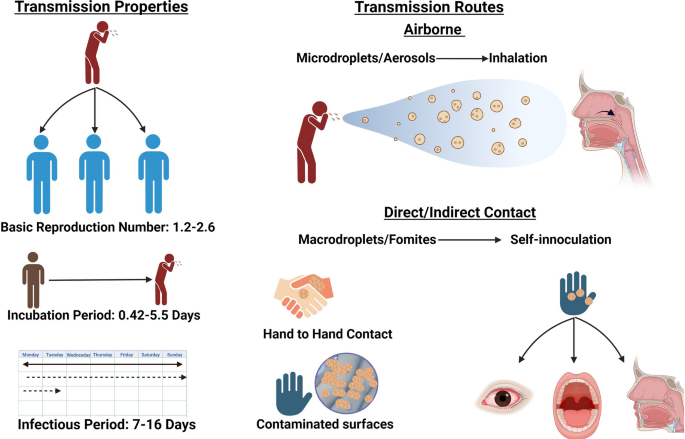
Descripción general de la transmisión de rinovirus humano (HRV). El HRV es altamente infeccioso y puede transmitirse de manera efectiva a través del contacto y el aire …
(Tagstotranslate) rinovirus