Resumen
Los cortes de pulmón de precisión (PCLS, por sus siglas en inglés) han surgido como un modelo ex vivo sofisticado y fisiológicamente relevante para estudiar las complejidades de las enfermedades pulmonares, incluidas la fibrosis, las lesiones, la reparación y los mecanismos de defensa del huésped. Esta metodología innovadora presenta una oportunidad única para cerrar la brecha entre los cultivos celulares in vitro tradicionales y los modelos animales in vivo, ofreciendo a los investigadores una representación más precisa del intrincado microambiente del pulmón. Los PCLS requieren el seccionamiento preciso del tejido pulmonar para mantener su integridad estructural y funcional. Estos cortes finos sirven como herramientas invaluables para diversas iniciativas de investigación, particularmente en el ámbito de las enfermedades de las vías respiratorias. Al proporcionar un microambiente controlado, los cortes de pulmón de precisión permiten a los investigadores diseccionar y comprender las interacciones y respuestas multifacéticas dentro del tejido pulmonar, lo que avanza en nuestra comprensión de la fisiopatología pulmonar.
Introducción
La historia de los cortes de pulmón con cortes de precisión se remonta al desarrollo general de técnicas para preparar y estudiar cortes de tejido en general. El desarrollo de técnicas de corte de tejido comenzó a fines del siglo XIX y principios del XX, cuando los investigadores utilizaron instrumentos especializados para cortar secciones delgadas de varios tejidos para su examen microscópico, pero el uso del micrótomo para la preparación de cortes de pulmón se publicó por primera vez en 1944 (1). El término “corte de precisión” implica un alto grado de exactitud y consistencia en la preparación de cortes de tejido. A mediados del siglo XX, los avances en la tecnología del micrótomo/vibratomo y otros instrumentos de corte permitieron la creación de cortes con mayor precisión, como se muestra en la Fig. 1La aplicación de técnicas de corte de precisión al tejido pulmonar probablemente siguió las tendencias generales en el corte de tejidos.
Figura 1Generación de cortes de pulmón humano. Los lóbulos de los pulmones de donantes sanos o enfermos se inflaron con una agarosa de bajo punto de fusión, se dejó que la agarosa se solidificara en los pulmones y se seccionó el tejido pulmonar. Se utilizó un punzón o herramienta de extracción de núcleos para generar columnas de tejido que contienen vías respiratorias, que se introducen en un Precisionary Instruments Vibratome© para generar cortes de ~350 µm de espesor. Se identificaron las vías respiratorias en estos cortes y se pesaron con pesas de platino con hilos de nailon para evaluar los cambios en la contracción y relajación de las vías respiratorias.
Imagen de tamaño completoInicialmente, se utilizaron cortes de pulmón para estudios toxicológicos con el fin de examinar la supervivencia celular frente a la exposición a contaminantes ambientales/industriales (2,3,4,5). Posteriormente, se reconoció la importancia de mantener la composición fisiológica del tejido para los experimentos, y los cortes de pulmón cortados con precisión ganaron popularidad y aceptación (como se revisó en (6)). En lo que respecta a la investigación respiratoria, el PCLS se volvió particularmente valioso para estudiar la reactividad de las vías respiratorias y la función pulmonar, la fibrosis, la capacidad de respuesta vascular, las respuestas a los agentes farmacológicos/terapéuticos y la inmunología de las vías respiratorias. La plataforma PCLS mantiene la arquitectura del tejido pulmonar, incluidas las vías respiratorias, los vasos sanguíneos y el parénquima con el estudio de los tipos de células residentes en el contexto de todo el tejido pulmonar. A lo largo de los años, los avances en las tecnologías de imágenes y los métodos de preparación de tejidos ayudaron a mejorar la calidad, el rigor y la reproducibilidad de los estudios realizados utilizando cortes de pulmón. Los investigadores ahora pueden estudiar procesos dinámicos en tiempo real, como la constricción y dilatación de las vías respiratorias con mayor precisión, y pueden exponer los cortes a varias sustancias para evaluar sus efectos sobre la función pulmonar y las respuestas celulares selectivas, todo lo cual proporciona información sobre el desarrollo de fármacos y la evaluación de la seguridad de posibles terapias. El PCLS proporciona una simulación más realista del microambiente pulmonar para estudiar una variedad de enfermedades pulmonares.
En conjunto, las PCLS han surgido como una herramienta poderosa para estudiar una variedad de enfermedades pulmonares, incluyendo asma, enfermedad pulmonar obstructiva crónica, enfermedades pulmonares fibróticas (fibrosis pulmonar idiopática, sarcoidosis), enfermedades de la vasculatura pulmonar (hipertensión arterial pulmonar y displasia broncopulmonar), síndrome de dificultad respiratoria aguda, cáncer de pulmón y las consecuencias de la exposición a patógenos respiratorios. La complejidad funcional, la relevancia fisiológica y la versatilidad de la plataforma hacen de las PCLS un recurso invaluable para el estudio de las complejidades de las enfermedades pulmonares y para avanzar en el desarrollo terapéutico. A medida que los investigadores refinen la generación y los usos de las PCLS, la plataforma está preparada para desempeñar un papel fundamental en la profundización de nuestra comprensión de las enfermedades pulmonares y, en última instancia, en la mejora de los resultados clínicos para los pacientes con esas enfermedades. Esta revisión resumirá el uso de las PCLS para examinar varias enfermedades pulmonares y cómo esta plataforma puede fomentar una comprensión de los aspectos fundamentales de la biología pulmonar y la patobiología específica de la enfermedad, como se muestra en la Figura 1. 2Además, la plataforma puede servir como herramienta para nuevos descubrimientos terapéuticos en enfermedades pulmonares.
Figura 2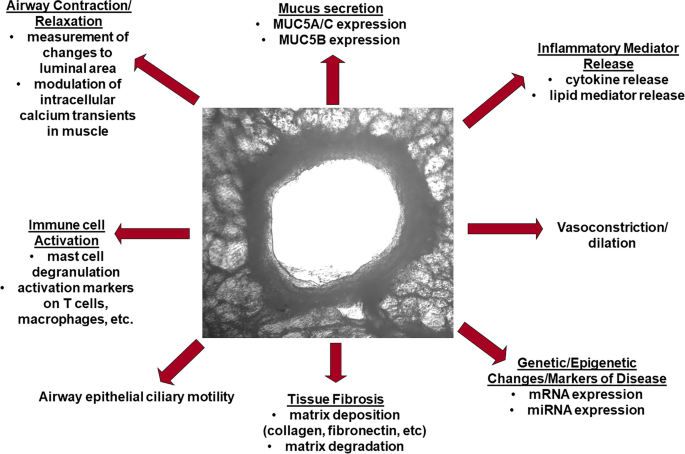
La gama de procesos que se pueden medir utilizando el PCLS como sistema modelo. Se puede estudiar una amplia variedad de puntos finales, desde cambios en la expresión genética hasta fibrosis tisular y más, utilizando este sistema modelo. Los resultados específicos se indican debajo de cada tipo de resultado medido
Imagen de tamaño completoEstudios en enfermedades infecciosas
La exposición a patógenos respiratorios se ha estudiado ampliamente en tipos de células de las vías respiratorias primarias e inmortalizadas; sin embargo, la PCLS ofrece un modelo tisular integrado para estudiar las consecuencias de la exposición y la infección. Se han examinado las respuestas del tejido a una variedad de patógenos respiratorios, incluidas las respuestas a la gripe, el rinovirus, el virus respiratorio sincitial, el SARS-CoV2, la infección pulmonar por hongos y especies bacterianas patógenas como Pseudomonas aeruginosa y Mycobacterium tuberculosis.
Un estudio sobre la influenza utilizó PCLS para demostrar que la exposición a PCLS regulaba negativamente la captación de albúmina, lo que perjudica la depuración de proteínas del espacio alveolar durante el síndrome de dificultad respiratoria aguda inducido por la gripe (7), y que la combinación de la exposición a la gripe A y al humo del cigarrillo disminuyó las respuestas a los broncodilatadores utilizados en el tratamiento del asma y la EPOC (8). La activación de las vías de detección de virus inducidas por la influenza y su capacidad para replicarse en PCLS después de la exposición al cigarrillo o al cigarrillo electrónico proporcionaron el modelo para informar que la exposición del tejido pulmonar al cigarrillo empeoró las respuestas a la influenza al suprimir la capacidad del pulmón para responder adecuadamente a la infección (9, 10). La secuenciación de células individuales derivadas de PCLS mostró que el extracto de vapeo amplificó las respuestas inflamatorias inducidas por la gripe (11). Los estudios también examinaron los efectos de inhibidores específicos de múltiples vías para tratar la infección por influenza y sus efectos (12,13,14,15), así como proporcionar información sobre las formas fundamentales en que el pulmón responde a la infección por influenza (dieciséis,17,18,19,20). Exposición a algunos virus específicos de la especie, incluido el virus del moquillo canino (21) y el virus de la neumonía murina (22), también se han examinado utilizando PCLS.
Las consecuencias funcionales de los virus respiratorios como el rinovirus (RV) y el virus respiratorio sincitial (VSR), que provocan el desarrollo de sibilancias y asma, además de inducir exacerbaciones del asma, han impulsado el uso de PCLS. Inflamación pulmonar después de la exposición al VSR en PCLS (23) identificaron nuevas estrategias de tratamiento, incluida la aplicación por vía mucosa de una vacuna contra el VRS (24) y modulación de un canal iónico (25) para atenuar los efectos del VRS. Gran parte de la investigación que se ha realizado para examinar los efectos del RV en las vías respiratorias se ha centrado en examinar la liberación de mediadores inflamatorios a partir de monocultivos de células epiteliales de las vías respiratorias. Curiosamente, la exposición al RV de PCLS puede modular tanto la contracción inducida por agonistas (26, 27) y relajación (28) de las vías respiratorias que parecen ser específicas del serotipo y del estado de la enfermedad. Las respuestas inflamatorias provocadas por el RV también se han estudiado en el PCLS (29), con la adición de diferentes estrategias de tratamiento que muestran una reducción de la inflamación inducida por RV (30, 31).
La pandemia del SARS-CoV2 catapultó la exposición a los virus respiratorios a la vanguardia de los esfuerzos de investigación de los científicos a nivel mundial, y el PCLS proporcionó una plataforma relevante para estudiar aspectos de la infección y la respuesta a la infección en el pulmón. Un estudio inicial utilizó varias cepas del virus de la bronquitis infecciosa, que son coronavirus aviares, para examinar la infección del pulmón con estos virus (32). Se ha logrado una comprensión de los mecanismos que impulsan la inflamación asociada con el SARS-CoV2, así como los mecanismos de replicación y las características patológicas de la enfermedad utilizando PCLS (33,34,35). Otros laboratorios identificaron terapias efectivas que podrían atacar la infección por SARS-CoV2 en el PCLS (36,37,38,39,40).
Si bien se ha prestado mucha atención a la exposición de los pulmones a patógenos virales, también hay bacterias y hongos patógenos que infectan los pulmones y provocan inflamación y enfermedad. Los investigadores han utilizado componentes de bacterias, incluido el lipopolisacárido (LPS), para estimular los receptores de reconocimiento de patrones en una variedad de tipos de células en el PCLS. El LPS indujo una regulación positiva de las respuestas inmunitarias innatas en consonancia con la exposición de los pacientes a endotoxinas (41); El LPS tuvo poco efecto sobre la constricción o relajación de las vías respiratorias inducida por agonistas (42); y la activación del receptor tipo Toll 2 (TLR2) redujo la capacidad de los broncodilatadores para inducir la relajación de las vías respiratorias murinas (43). También se han examinado las consecuencias de la exposición a la bacteria patógena Pseudomonas aeruginosa en el PCLS (44,45,46,47), y un estudio muestra que algunas cepas de bacterias comensales presentes en el pulmón de pacientes con fibrosis quística pueden proteger al huésped de la inflamación inducida por P. aeruginosa (46), y otro que observa una respuesta inmune/inflamatoria más robusta en ratones más jóvenes en comparación con ratones más viejos de la misma cepa cuando se exponen a…



