Resumen
La disfunción de las vías respiratorias pequeñas (SAD) en el asma se caracteriza por la inflamación y el estrechamiento de las vías respiratorias con menos de 2 mm de diámetro entre las generaciones 8 y 23 del árbol bronquial. Ahora se acepta ampliamente que las vías respiratorias pequeñas están involucradas en la patogenia del asma y son un determinante importante de la obstrucción del flujo de aire en esta enfermedad.
En los últimos años, se han desarrollado pruebas especializadas, como la oscilometría de impulso (IOS) y las pruebas de lavado de nitrógeno en respiración múltiple (MBNW), que se han considerado más precisas para detectar SAD que la espirometría convencional. Los estudios clínicos muestran que el SAD se asocia con una hiperreactividad bronquial más grave, un peor control del asma y un mayor riesgo de exacerbaciones. Los datos recientes de un gran estudio de cohortes mostraron que la prevalencia de SAD en pacientes con asma aumenta con la gravedad del asma. En general, el SAD parece representar un rasgo tratable, lo que lo hace atractivo para la optimización del control del asma y la reducción de la tasa de exacerbaciones, especialmente en el asma de moderada a grave.
Los agentes biológicos ahora están disponibles para el tratamiento de diferentes fenotipos y endotipos de asma grave. Sin embargo, el efecto de estas terapias en SAD sigue estando pobremente caracterizado. Se está acumulando literatura que muestra que los agentes biológicos también pueden mejorar favorablemente la función de las vías respiratorias pequeñas. En particular, los agentes anti-IL5 (mepolizumab y benralizumab) parecen tener un mayor impacto en el SAD en comparación con otros agentes biológicos, pero faltan comparaciones directas en ensayos controlados aleatorios prospectivos.
En este miniartículo de revisión, abordamos la evidencia más reciente sobre el efecto de las terapias biológicas en el SAD en pacientes con asma grave.
Introducción
El asma es una condición crónica y heterogénea que afecta las vías respiratorias, caracterizada por infiltración inflamatoria y remodelación del árbol bronquial [1]. Incluso si el asma afecta a todo el árbol bronquial, las vías respiratorias pequeñas (aquellas con un diámetro interno ≤ 2 mm) han sido reconocidas como el sitio principal de limitación del flujo de aire tanto en el asma como en la enfermedad pulmonar obstructiva crónica (EPOC) [2, 3].
Muchos estudios y revisiones sistemáticas han sugerido que la disfunción de las vías respiratorias pequeñas (SAD) se asocia con una hiperreactividad bronquial más grave, un peor control del asma y un mayor número de exacerbaciones [4,5,6,7,8,9,10,11].
De acuerdo con las directrices actuales de la Iniciativa Global para el Asma (GINA), la espirometría sigue siendo el método de elección para evaluar la función respiratoria. [12]. Sin embargo, la espirometría convencional refleja principalmente la variabilidad y/o la reversibilidad de la obstrucción de las vías respiratorias y no puede evaluar con sensibilidad las vías respiratorias pequeñas, y se vuelve anormal solo cuando aproximadamente el 75 % de las vías respiratorias pequeñas están obstruidas. [13]. Hasta la fecha, existen numerosas técnicas diagnósticas disponibles para evaluar SAD, desde no invasivas hasta mínimamente invasivas o invasivas, como la espirometría (FEF25-75%, FVC, FVC/SVC), la oscilometría de impulso (IOS) (R5-R20, X5 , ΔX5in-esp, AX, Fres), prueba de lavado con nitrógeno en respiración única (SBNW) o lavado con nitrógeno en respiración múltiple (MBNW), pletismografía corporal (RV, RV/TLC), tomografía computarizada de alta resolución (HRCT), medicina nuclear (gammagrafía , SPECT, PET), resonancia magnética nuclear (RMN) con 3He, inducción de esputo y broncoscopia [11].
La mayor prevalencia de SAD, según la definición de IOS, en etapas más graves de asma se ha confirmado en varios estudios de la vida real y el ensayo ATLANTIS, en el que las anomalías periféricas persistieron a pesar de una mayor dosis diaria de corticosteroides inhalados (ICS), lo que sugiere que las terapias actuales tienen poco efecto sobre las anomalías estructurales de las vías respiratorias o la administración periférica deficiente de la terapia inhalada [4, 8, 14,15,16,17].
Se ha sugerido un nuevo enfoque personalizado, denominado enfoque de “rasgos tratables”, para abordar las limitaciones de las estrategias de tratamiento existentes. [18, 19].
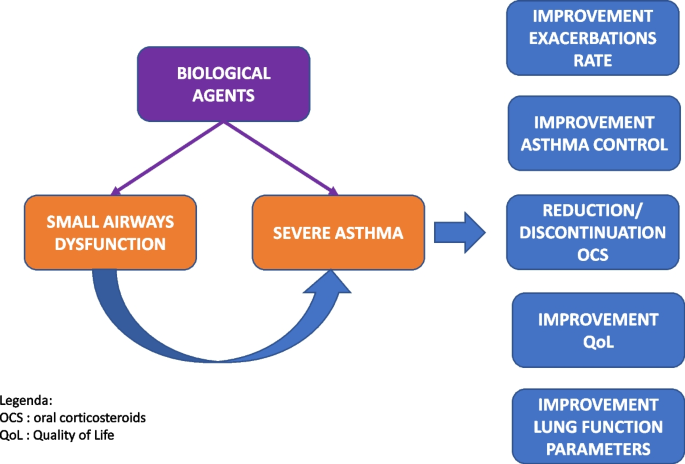
Desde esta perspectiva, el SAD parece poseer las características de un rasgo pulmonar tratable, lo que lo hace ciertamente atractivo para la optimización del control del asma y la reducción de la tasa de exacerbaciones. [11]. Esto parece especialmente importante en la perspectiva de avanzar hacia la medicina de precisión. La introducción de agentes biológicos para el tratamiento del asma grave ha demostrado ser muy eficaz, tanto en ensayos clínicos aleatorizados como en estudios reales, y está en línea con el concepto de medicina de precisión. Por lo tanto, demostrar que los agentes biológicos también pueden mejorar favorablemente la función de las vías respiratorias pequeñas parece ser de crucial importancia (Fig. 1).
En este miniartículo de revisión, abordamos la evidencia más reciente sobre el efecto de las terapias biológicas sistémicas en la enfermedad de las vías respiratorias pequeñas en pacientes con asma grave.
SAD: prevalencia, asociación con fenotipos específicos de asma y mal control del asma
La prevalencia de SAD en el asma parece ser muy alta, probablemente del 50 % o más, según los estudios realizados hasta la fecha. [20]. En el estudio ATLANTIS, el estudio multinacional más grande que muestra la contribución de SAD a la gravedad del asma, se encontró que el 91 % de los asmáticos tenían SAD, que estaba fuertemente presente en todos los pasos de gravedad de GINA [4].
El SAD se ha asociado con algunos fenotipos clínicos, como fumadores activos, pacientes de edad avanzada con asma de larga evolución y presencia de obstrucción fija al flujo aéreo, pacientes con síntomas nocturnos e inducidos por el ejercicio y asma grave/no controlada. [6, 7, 9]. En estudios de la vida real más recientes, los análisis multivariables, el análisis del árbol de clasificación y el modelado de ecuaciones estructurales indicaron que los síntomas inducidos por el ejercicio, el sobrepeso/obesidad, los síntomas nocturnos relacionados con el asma, la edad avanzada, el tabaquismo y la inflamación tipo 2 son fuertes predictores independientes de SAD en pacientes con asma manejada por la comunidad [8, 21,22,23]. Estas características pueden ayudar a identificar SAD entre pacientes con asma, especialmente cuando no se puede realizar IOS.
La identificación de SAD es de particular importancia ya que está fuertemente asociada con un peor control del asma. En el estudio ATLANTIS, el SAD (identificado tanto por IOS como por espirometría) se asoció significativamente con el control del asma, los antecedentes de exacerbación y la gravedad de la enfermedad [4]confirmando datos preliminares de estudios de la vida real [8]. Kraft y sus colegas publicaron recientemente los datos de seguimiento longitudinal de un año del estudio ATLANTIS, que mostraron que el SAD se asoció longitudinalmente con un control deficiente del asma, las exacerbaciones y la calidad de vida. [5].
Estos resultados son consistentes con otros datos publicados, en los que el control del asma estaba estrechamente relacionado con el SAD y los fenotipos clínicos asociados con el SAD. [8, 11, 21,22,23,24,25,26,27]. Cabe destacar que, en la mayoría de estos estudios, la IOS se asocia mejor con el control del asma que la espirometría, lo que respalda la importancia de utilizar IOS y herramientas más modernas además de la espirometría en la evaluación del control del asma.
SAD en asma grave
La inflamación crónica que caracteriza al asma afecta a todo el pulmón, desde las vías respiratorias grandes proximales hasta las pequeñas distales. La afectación de las vías respiratorias pequeñas contribuye a la morbilidad del asma, en particular del asma grave. Los desafíos para implementar evaluaciones de las vías respiratorias pequeñas en el entorno clínico de rutina y como parte del tratamiento del asma grave incluyen aspectos técnicos de la evaluación y el seguimiento del SAD, y el impacto de las vías respiratorias pequeñas en la administración y los resultados terapéuticos del asma. [28]. Se considera que alrededor del 5 al 10% de los pacientes con asma tienen una enfermedad grave. [29], que representa hasta el 50 % de los costes sanitarios totales relacionados con el asma. El asma grave se puede dividir en varios fenotipos/endotipos, de los cuales el asma eosinofílica grave se encuentra entre los más estudiados. [30]. Las autopsias de casos fatales de asma mostraron inflamación intensa, anomalías en la estructura de las vías respiratorias pequeñas y taponamiento luminal en las vías respiratorias periféricas. [31, 32].
A pesar de la evidencia de una asociación entre el SAD y la inflamación neutrofílica de las vías respiratorias [33]se demostró recientemente que la inflamación eosinofílica de las vías respiratorias, en lugar de la neutrofílica, es el principal impulsor del SAD en el asma [34].
En el estudio ATLANTIS, el SAD estuvo fuertemente presente en todas las etapas de gravedad de GINA, pero fue consistentemente más alto en el asma más grave (paso 5 de GINA), similar a los hallazgos de estudios anteriores. [8, 15, 21].
Los avances en el conocimiento de los diferentes fenotipos y endotipos del asma grave han dado lugar a terapias muy innovadoras, como los agentes biológicos para el asma grave. Estos medicamentos están dirigidos principalmente contra las citocinas y las células involucradas en la vía inflamatoria tipo 2, modificando así el curso natural de la enfermedad al reducir la inflamación de las vías respiratorias sin el daño colateral asociado con el uso de corticosteroides sistémicos. En este contexto, parece ser de crucial importancia demostrar que los agentes biológicos también pueden mejorar favorablemente la función de las vías respiratorias pequeñas. En particular, parece prospectivamente importante lograr la modulación por parte de agentes biológicos de la actividad de los eosinófilos a nivel de las vías aéreas distales.
Agentes SAD y anti-IgE (omalizumab)
Omalizumab, un anticuerpo antiIgE monoclonal recombinante humanizado, inhibe la unión de IgE sérica a los receptores FcεRI en mastocitos y basófilos, lo que reduce la respuesta inflamatoria causada por la activación de dichas células efectoras al interactuar con el alérgeno. [35]. También se ha demostrado que omalizumab tiene un efecto preventivo sobre las exacerbaciones inducidas por virus en niños con asma alérgica al reducir la susceptibilidad a las infecciones por rinovirus. [36]. Muchos ensayos han demostrado que omalizumab reduce significativamente el número de exacerbaciones graves, las dosis de corticosteroides inhalados y/u orales y mejora la calidad de vida en niños, adolescentes y adultos con asma alérgica grave. [37, 38].
En cuanto al impacto de omalizumab en el SAD, algunos trabajos han evaluado este aspecto con resultados contradictorios (Tabla 1).
Huang et al. evaluó la eficacia a largo plazo de omalizumab en pacientes adultos con asma alérgica grave comparando el tratamiento continuo frente al tratamiento de refuerzo [39].
De los 124 pacientes tratados, se encontró una reducción significativa en las exacerbaciones anuales y una mejoría en SAD evaluado por FEF25-75% en el grupo de continuación (norte= 110). Por el contrario, el grupo de refuerzo (norte= 14) tuvieron un aumento significativo de las exacerbaciones anuales, deterioro de la función de las vías respiratorias pequeñas y peor control del asma, lo que sugiere que es preferible el tratamiento continuo con omalizumab.
En otro estudio realizado por Pasha et al., omalizumab no redujo la concentración de NO alveolar (CalvNO), lo que podría reflejar una inflamación de las vías respiratorias pequeñas. Sin embargo, los autores concluyeron que el modelo que utilizaron puede no haber sido lo suficientemente sensible para detectar pequeños cambios en CalvNO. [58].
En otro estudio realizado por Taijri et al. el objetivo era evaluar exhaustivamente la eficacia de omalizumab, incluidos sus efectos sobre las vías respiratorias pequeñas y la remodelación de las vías respiratorias, en pacientes adultos con asma refractaria grave. La evaluación mediante tomografía computarizada reveló que el grosor de la pared de las vías respiratorias se redujo significativamente después de 48 semanas de tratamiento con omalizumab (no se encontraron cambios significativos a las 16 semanas). En cambio, el omalizumab no influyó en el FEF del 25 % al 75 %, pero solo se evaluó una pequeña muestra de pacientes [40].
En un análisis multicéntrico durante 2 años, los autores encontraron una disminución en la relación RV y RV/TLC a los 6 meses, pero ningún cambio significativo en la TLC en pacientes tratados con omalizumab. Después de 6 meses, RV empeoró ligeramente pero RV/TLC se mantuvo estable. El RV es mayor en pacientes con atrapamiento aéreo, fenómeno que se observa en parte en las alteraciones de las vías aéreas periféricas. Curiosamente, se observó una mayor mejoría del VD en pacientes con obstrucción grave de las vías respiratorias (FEV1 ≤ 50%) que en aquellos con menos obstrucción. Estos pacientes pueden tener pulmón…