Resumen
Se proyecta que la enfermedad pulmonar obstructiva crónica (EPOC) se convierta en la tercera causa principal de muerte a nivel mundial para 2030, lo que representa el 71.9% de los casos de enfermedades respiratorias crónicas en 2019. El diagnóstico temprano de la EPOC (ECOPD) depende en gran medida del monitoreo clínico de las funciones pulmonares, con una fuerte influencia de la exposición de fumar, que no puede alinearse bien con la progresión de la enfermedad. Como tal, las pautas de oro 2022-2024 enfatizan el descubrimiento de marcadores biológicos sobre los síntomas clínicos para la detección temprana. Este estudio explora las características biológicas de la ECOPD en una cohorte de 176 adultos del estudio de salud pulmonar de China, que consisten 88 controles sanos (HC) y 88 ECOPD diagnosticados clínicamente, coincidentes para la edad, el género y el historial de tabaquismo. Si bien las pruebas de función pulmonar revelaron diferencias entre HC y ECOPD, no se observaron distinciones significativas en los análisis de sangre de rutina. El análisis de proteómica identificó 377 proteínas plasmáticas comunes a ambos grupos, con proteínas de baja intensidad que impulsan las diferencias específicas del grupo. La regresión logística univariable y el análisis de enriquecimiento del conjunto de genes identificaron 248 proteínas asociadas con ECOPD, particularmente aquellas involucradas en el proceso de inflamación. La validación en una cohorte independiente confirmó la asociación de 15 proteínas con ECOPD. El análisis de metabolómica del plasma identificó 1788 metabolitos, 137 de los cuales se encontraron vinculados a ECOPD. Los modelos de aprendizaje automático indicaron que un enfoque múltiple múltiple proporcionó la mejor predicación de la función pulmonar (R2 = 0.74), mientras que la proteómica sola diagnosticó efectivamente ECOPD (AUC = 0.949). La fusión y la agrupación de la red de similitud revelaron dos subgrupos de ECOPD: uno por marcadores de respuesta inflamatoria inmune, y el otro por la presencia de aquellos relacionados con la hemostasia o la función del músculo liso vascular. Estos hallazgos subrayan el potencial de la integración múltiple múltiple para distinguir los subgrupos de ECOPD y predecir el riesgo de enfermedad.
Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por síntomas respiratorios persistentes y limitación del flujo de aire, causada por anormalidades en las vías respiratorias o alveolares, típicamente como resultado de una exposición prolongada a partículas o gases nocivos. Según la carga global de la enfermedad, en 2019, hubo 212 millones de pacientes con EPOC en todo el mundo, lo que contribuyó a 74,4 millones de años de vida global ajustados por discapacidad (DALYS), lo que representaron el 71.9% de la carga de las enfermedades de respiración crónica (1). Aunque la EPOC puede originarse temprano en la vida, sus manifestaciones clínicas generalmente toman años en emerger, lo que hace que la identificación temprana sea un desafío (2). La EPOC temprana (ECOPD) es la fase inicial en la patogénesis de la EPOC, relacionada con los mecanismos primarios que eventualmente conducen a la EPOC. Clínicamente, se define como individuos menores de 50 años con al menos 10 años de exposición al tabaquismo y un volumen expiatorio forzado de línea de base en 1 s (FEV1)/capacidad vital forzada (FVC) por debajo del límite inferior de lo normal (LLN) () (3). Sin embargo, solo el 24% de los diagnosticados con ECOPD desarrollan EPOC en toda regla en una década (4–5). Esto indica que la comprensión de ECOPD permanece incompleta.
La etapa biológica «temprana» de la EPOC, vinculada al mecanismo inicial de la enfermedad. Por lo tanto, para la prevención efectiva, es crucial detectar la EPOC temprana biológica, en lugar de la EPOC temprana clínica que muestra los síntomas, impedimentos funcionales o anomalías estructurales de primer año. Se han aplicado enfoques de Omics, como transcriptómica, proteómica y metabolómica, para descubrir mecanismos moleculares y definir los caracteres biológicos de la EPOC. Por ejemplo, los biomarcadores transcriptómicos (p. Ej., ASAH1, CEBPD, FOXP1, TCF7) están vinculados a la función pulmonar (6–7), se han identificado marcadores proteómicos (p. Ej., TIMP1, BPIFB1, CNDP1) (8,9,10), y los biomarcadores metabolómicos (por ejemplo, esfingolípidos) se encuentran asociados con exacerbación (6). Desafortunadamente, estos estudios utilizan principalmente muestras de plasma de pacientes con EPOC en la etapa tardía, lo que limita su utilidad para la detección temprana. Todavía no hay caracteres biológicos de diagnóstico unificados y factibles para ECOPD.
En este estudio, realizamos análisis de proteómica y metabolómica en muestras de plasma de la cohorte de estudio de salud pulmonar de China (CPHS) (11) y una cohorte de validación separada para investigar las firmas biológicas de ECOPD. Identificamos firmas proteómicas y metabolómicas asociadas con ECOPD clínicamente definido, caracterizadas por la función pulmonar y las exposiciones al tabaquismo. ECOPD mostró características proteómicas y metabolómicas proinflamatorias, incluidas las vías relacionadas con la inmunidad de leucocitos y el metabolismo de aspartato. En particular, un modelo de regresión de contracción y selección menos absoluta proteómica (LASSO) superó a otros modelos basados en Omics para distinguir controles sanos (HC) de ECOPD. Además, 20 individuos en el grupo HC exhibieron características múltiples múltiples similares a las de ECOPD, lo que sugiere una mayor probabilidad de progresar a ECOPD.
Métodos y materiales
Materiales y reactivos
El acetonitrilo (ACN) y el agua se compraron de Fisher Chemical. 1,4-ditiotreitol (DTT), UERA y yodoacetamida (IAA) se adquirieron de Sigma-Aldrich. La tripsina modificada de grado de secuenciación se adquirió de Promega. El kit de BCA se adquirió a Beyotime, y IRT Kit se adquirió de Bionosys. El cóctel inhibidor de la proteasa se adquirió de Calbiochem. Todos los demás productos químicos utilizados fueron de grado analítico o superior.
Participantes del estudio
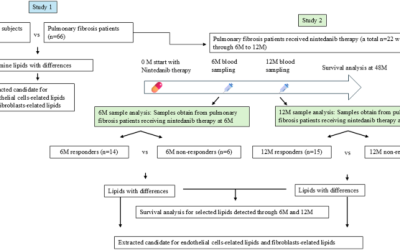
Los participantes en la cohorte de Discovery fueron recolectados de la cohorte de la Encuesta Nacional de Salud de la Población (CPHS). La cohorte CPHS se recolectó entre junio de 2012 y mayo de 2015 que cubrió a los participantes de las ciudades y condados en la provincia de Guizhou. Los criterios de inclusión y exclusión de los controles sanos se limitaron como individuos menores de 50 años, relación basal de FEV1/FVC sobre el LLN, sin comorbilidades, incluidas las enfermedades cardiovasculares (enfermedad de la arteria coronaria, hipertensión, insuficiencia cardíaca, arritmias), enfermedades cerebrovasculares (accidente cerebrovascular) y diabetes. Los criterios de inclusión de los pacientes con ECOPD se limitaron como los individuos menores de 50 años, la relación basal de FEV1/FVC cayendo por debajo del LLN, con o sin exposición al tabaquismo. Los criterios de exclusión de ECOPD abarcaron a las personas que se habían sometido a cirugía torácica, abdominal o ocular en los últimos tres meses, aquellos ingresados en el hospital por afecciones cardíacas en el mes anterior, individuos con una frecuencia cardíaca superior a 120 latidos por minuto, aquellos que recibieron quimioterapia antibacteriana por tuberculosis y las mujeres que estaban embarazadas o en breve. Como resultado, se recogió la cohorte de descubrimiento que consta de 88 controles sanos y 88 pacientes con ECOPD, coincidieron con la edad, el género y la exposición al tabaquismo. La otra cohorte de validación que consta de 35 control saludable y 35 ECOPD de la provincia de Guizhou se recolectó independientemente utilizando los mismos criterios de inclusión y exclusión.
El consentimiento informado por escrito se obtuvo de todos los participantes, y el estudio se realizó de acuerdo con la Declaración de Helsinki y aprobado por el Comité de Revisión de Ética de Beijing Chaoyang Hospital, Capital Medical University (201002008) e Instituto de Ciencias Médicas Básicas, Academia de Ciencias Médicas Chinas (065-2021), junto con otras instituciones colaborativas de colaboración, Hospital de Guía de Guías de Guías de Guías (202101).
Recopilación de plasma y recopilación de información clínica
Después de la prueba de rutina de sangre, la sangre completa en los tubos de Vacutainer EDTA se colocó inmediatamente en hielo y se centrifugaron (3000 r/min, 10 minutos a 4 ° C) en 30 minutos. El plasma separado se almacenó a -80 ° C hasta su uso posterior. Mientras tanto, las características detalladas (p. Ej., Número de identificación, edad, sexo e indicadores clínicos) se recolectaron exhaustivamente.
Preparación de muestra para proteómica y análisis de datos
Digestión de proteínas y fraccionamiento
Se combinaron múltiples muestras de plasma en una mezcla agrupada para la construcción de la biblioteca espectral. Para cada muestra, la concentración de proteína se midió con el kit de ensayo de proteína BCA (Thermo Fisher Scientific, 23227) de acuerdo con la instrucción proporcionada por el fabricante. El plasma de 10 µl se redujo con ditiotreitol 5 mM durante 30 minutos a 56 ° C y se alquiló con yodoacetamida 11 mM durante 15 minutos a temperatura ambiente en la oscuridad. Las muestras alquiladas se transfirieron a tubos de ultrafiltración para la digestión FASP. Las muestras se reemplazaron en primer lugar con 8 m de urea durante 3 veces a 12,000 g a temperatura ambiente durante 20 minutos, y luego se reemplazaron con 100 mm de TEAB durante 3 veces. La tripsina se agregó a 1:50 relación de masa de tripsina a proteína para la digestión a 37 ° C durante la noche. El péptido se recuperó por centrifugación a 12,000 g durante 10 minutos a temperatura ambiente, y se repitió dos veces. Finalmente, los péptidos combinados fueron desalados por la columna C18 SPE. Además, la muestra se fraccionó en fracciones por HPLC de fase inversa de pH alto usando la columna Agilent 300 extender C18 (partículas de 5 μm, ID de 4.6 mm, 250 mm de longitud). En cuanto a las muestras mixtas para la construcción de la biblioteca, los péptidos se separaron primero con un gradiente de acetonitrilo al 8-32% en pH de bicarbonato de amonio 10 mM 9 durante 60 minutos en 60 fracciones. Luego, los péptidos se combinaron en 12 fracciones y se secaron por centrifugación de vacío.
Adquisición y análisis de datos de DDA
Para la adquisición dependiente de datos (DDA): análisis LC-MS/MS, el kit IRT se agregó a todas las fracciones de acuerdo con las instrucciones del fabricante. A continuación, los péptidos trípticos se disolvieron en el disolvente A (ácido fórmico al 0,1%, acetonitrilo al 2%), cargados directamente en una columna analítica de fase invertida casera (25 cm de longitud, 100 μm de identificación). Los péptidos se separaron con un gradiente de 4 a 24% del solvente B (0.1% de ácido fórmico en 90% de acetonitrilo) durante 60 minutos, 24-32% en 29 minutos y subió a 80% en 3 minutos que se mantiene al 80% durante los últimos 3 minutos, todo a una tasa de flujo constante de 500 NL/min en un sistema Easy NLC 1200 UPLC (Thermo Fisher Scientific). Los péptidos separados …
(Tagstotranslate) Neumología/sistema respiratorio