Resumen
Antecedentes
Existe una necesidad desesperada de identificar biomarcadores más precisos y eficientes para las respuestas ICI en pacientes con CPCP.
Métodos
Los datos de nuestro estudio se obtuvieron del estudio IMpower133. Un total de 202 pacientes con CPCP recibieron el tratamiento de placebo más carboplatino más etopósido (EC), mientras que un total de 201 pacientes con CPCP recibieron el tratamiento de atezolizumab más EC. La supervivencia global (SG) se comparó mediante análisis de Kaplan Meier. Se utilizó un análisis de regresión de Cox univariado y multivariado para determinar las variables pronósticas independientes que afectan la SG en pacientes con CPCP.
Resultados
Hemos demostrado que una TMB más alta ajustada por una proporción neutrófilos-linfocitos (NLR) más baja se correlaciona significativamente con una mejor SG, en pacientes con CPCP sujetos a atezolizumab o placebo (P = 0,001 para atezolizumab y P = 0,034 para placebo). Además, el modelo de Cox mostró que TMB < 10 mut/Mb ajustado por NLR ≥ mediana fue un factor independiente de SG para pacientes con CPCP tratados con atezolizumab (cociente de riesgos[HR]2,82; intervalo de confianza del 95 %; 1,52–5,24; P = 0,001). Tanto el análisis de regresión de Cox univariado como el multivariado mostraron que para los pacientes con CPCP que albergan NLR bajo y TMB alta, la supervivencia es significativamente más larga en aquellos tratados con atezolizumab que en aquellos tratados con placebo. El beneficio de supervivencia es significativamente mayor en los pacientes con CPCP tratados con atezolizumab que en los tratados con placebo (P = 0,018 para el punto de corte de TMB = 10 mut/Mb, P = 0,034 para el punto de corte de TMB = 16 mut/Mb).
Conclusión
Nuestros hallazgos brindan una perspectiva prometedora sobre la utilidad del TMB ajustado por NLR en el pronóstico y las respuestas inmunes en pacientes con CPCP.
Introducción
El cáncer de pulmón de células pequeñas (SCLC) es una enfermedad letal con una supervivencia pésima. La llegada de los inhibidores de los puntos de control inmunitario (ICI) ha marcado el comienzo de un nuevo paradigma de tratamiento y ha prolongado sustancialmente la supervivencia en el SCLC. Recientemente, la incorporación de inmunoterapia al carboplatino y al etopósido ha dado como resultado una mayor eficacia en comparación con la quimioterapia sola en el SCLC (1). El ensayo IMpower133, que evalúa tanto la eficacia como la seguridad de atezolizumab más carboplatino y etopósido en pacientes con CPCP en estadio extenso (ES-CPCP), ha demostrado que se observó una supervivencia general (SG) y una supervivencia libre de progresión (SLP) significativamente más prolongadas en pacientes con atezolizumab, logrando así un avance sin precedentes en el tratamiento del CPCP (2). A pesar de la mejora de la supervivencia general, la respuesta a la ICI se ha encontrado solo en una pequeña fracción de pacientes con CPCP. Por lo tanto, la selección de pacientes adecuados con CPCP que se benefician de la terapia con ICI es de gran importancia para lograr un beneficio clínico optimizado. Se ha informado que varias características clínicas, como el ligando 1 de muerte celular programada por tumores (PD-L1) y la carga mutacional tumoral (TMB), están asociadas con las respuestas a la ICI en el CPCP (3,4,5). Sin embargo, estos biomarcadores tienen una utilidad limitada y carecen de evidencia sólida para la selección adecuada de pacientes (6, 7). Por lo tanto, existe una necesidad desesperada de explorar biomarcadores más confiables para ayudar a guiar el tratamiento inmunoterapéutico en el CPCP.
La relación neutrófilos-linfocitos (NLR), un parámetro inflamatorio, se ha adoptado para predecir la supervivencia y la respuesta a los tratamientos contra el cáncer (8, 9). Cada vez hay más evidencias que demuestran una asociación íntima entre el NLR y las respuestas a la ICI entre los pacientes con cáncer debido a su papel subyacente en la inflamación sistemática y su interacción con el sistema inmunológico. Un estudio previo demostró que la alta expresión del NLR antes del tratamiento está vinculada con una supervivencia global y una supervivencia libre de progresión más cortas y con una respuesta debilitada en pacientes con cáncer de pulmón de células no pequeñas (CPCNP) metastásico sometidos a nivolumab (10). Sin embargo, el papel predictivo del NLR en pacientes con CPCP sometidos a ICI ha sido ampliamente desconocido. Además, el valor potencial de TMB después del ajuste del NLR en la respuesta a ICI tampoco está bien dilucidado.
Primero evaluamos el papel de los niveles de TMB y NLR en la predicción de ICI entre pacientes con CPCP. Luego analizamos el valor predictivo de combinar TMB con NLR en pacientes con CPCP sometidos a ICI. Mostramos que un TMB más alto ajustado por un NLR más bajo se asocia con una supervivencia prolongada en pacientes con CPCP tratados con atezolizumab. Además, se ha encontrado una supervivencia mejorada en pacientes con CPCP que albergan TMB más alto ajustado por un NLR más bajo entre aquellos tratados con atezolizumab o placebo. Nuestro estudio ha demostrado que el TMB ajustado por NLR proporciona utilidad predictiva en pacientes con CPCP sometidos a ICI.
Métodos
Fuentes de datos
Los datos de nuestro estudio se obtuvieron del estudio IMpower133. El estudio IMpower133 es un estudio aleatorizado, doble ciego, de fase I/III, que demostró que la adición de atezolizumab a carboplatino más etopósido (EC) para el tratamiento de primera línea del CPCNP-ES resultó en una mejora significativa de la SG y la SSP en comparación con placebo más EC. El estudio y los datos se han publicado, por lo que no se justifica el consentimiento informado ni la aprobación del comité ético. Un total de 202 pacientes con CPCNP recibieron el tratamiento de placebo más EC, mientras que un total de 201 pacientes con CPCNP recibieron el tratamiento de atezolizumab más EC. Los datos recopilados incluyeron edad, sexo, raza, antecedentes de tabaquismo (TOBHX), años de tabaquismo, Eastern Cooperative Oncology Group (ECOG), suma inicial de los diámetros más largos (BASLD), número de metástasis, metástasis cerebral, metástasis hepática, células tumorales/células inmunitarias (TC/IC), TMB y NLR. El diagrama de flujo de los pacientes se mostró en la Figura 1 complementaria.
Clasificación de pacientes
TMB se define como el número de sustituciones de bases somáticas, codificantes e inserciones y deleciones cortas por megabase del genoma examinado (11). Con base en estudios previos, el valor de corte de TMB se estableció en ≥ 10 mut/Mb y ≥ 16 mut/Mb, lo que indica un estado de biomarcador positivo. El NLR se determinó dividiendo el recuento absoluto de neutrófilos por el recuento absoluto de linfocitos (12) y se calculó a partir del hemograma completo más reciente antes del tratamiento. El valor de corte del NLR se estableció en ≥ 3,44. En el análisis del efecto combinado del NLR y la TMB en la SG, asignamos a los pacientes en cuatro categorías de NLR alto/bajo y TMB alto/bajo, utilizando el valor de corte seleccionado de TMB = 10 mut/Mb y el valor de corte del NLR = 3,44.
Análisis estadístico
La SG se comparó mediante análisis de Kaplan Meier. Se utilizó un análisis de regresión de Cox univariante para determinar las variables pronósticas independientes que afectan a la SG en pacientes con CPCP. Se realizó un análisis de regresión de Cox multivariante para analizar el cociente de riesgos instantáneos (HR) de la SG en pacientes con CPCP según diferentes variables clínicas. Los resultados del análisis de subgrupos se presentan en los diagramas de bosque correspondientes. Todos los análisis estadísticos se realizaron utilizando R (versión 4.1), y un valor p < 0,05 se consideró estadísticamente significativo.
Resultados
Influencia de las características clínicas en la supervivencia de pacientes con CPCP tratados con atezolizumab más EC
Utilizando un modelo de regresión de riesgos proporcionales de Cox, investigamos la influencia de varias características clínicas en la SG: edad, sexo, raza, TOBHX, años de tabaquismo, ECOG, BASLD, número de metástasis, metástasis cerebral, metástasis hepática, TC/IC, TMB, NLR. En el análisis multivariado, ECOG (HR, 1,59; IC del 95 %, 1,07-2,37; P = 0,022), número de metástasis (HR, 1,58; IC del 95 %, 1,07-2,33; P = 0,022), metástasis hepáticas (HR, 1,69; IC del 95 %, 1,14-2,50; P = 0,008) y un NLR más alto (HR, 1,59; IC del 95 %, 1,10-2,29; P = 0,014) se asociaron con peor SG, mientras que TMB y otras características clínicas no se asociaron significativamente con SG (P > 0,5), como se demuestra en la Fig. 1.
Figura 1Gráficos de diagramas forestales que informan los cocientes de riesgo (HR) para el riesgo de muerte en pacientes con CPCNP-ES según variables clínicas. Estas variables clínicas incluyen edad, sexo, raza, TOBHX, años de tabaquismo, ECOG, BASLD, número de metástasis, metástasis cerebral, metástasis hepática, TC/IC, TMB y NLR. HR, cociente de riesgo
Imagen de tamaño completoEl papel de la combinación de TMB y NLR en la predicción de la supervivencia de pacientes con CPCP tratados con atezolizumab o placebo
Utilizando puntos de corte de TMB ≥ 10 mut/Mb y NLR de < mediana para biomarcadores positivos, investigamos la combinación de estos dos biomarcadores en la predicción de supervivencia entre pacientes con CPCP. Para pacientes con CPCP tratados con atezolizumab más EC, la SG fue significativamente más larga en pacientes con TMB ≥ 10 mut/Mb y NLR de < mediana, en comparación con otros grupos de pacientes. Aquellos que albergaban TMB < 10 mut/Mb y NLR ≥ mediana tuvieron una SG menor (SG mediana: 7,76 meses), lo que representa una diferencia significativa clara con otros grupos (P = 0,001). Además, se realizó un estudio a 20 pacientes con CPCP del Hospital e Instituto de Cáncer de Shandong, que recibieron inmunoterapia combinada con quimioterapia, para validar este resultado. El resultado mostró que la SG fue significativamente más larga en pacientes con TMB ≥ 10 mut/Mb y NLR de < mediana, en comparación con aquellos con TMB < 10 mut/Mb y NLR de ≥ mediana (P = 0,04; SG mediana: 17,10 meses frente a NA). Debido al pequeño tamaño de la muestra, no hubo diferencia estadísticamente significativa en la SG entre los pacientes con TMB ≥ 10 mut/Mb y NLR de < mediana y los otros dos grupos (P > 0,05) (Fig. Suplementaria 2). Del mismo modo, para los pacientes con CPCP tratados con EC, aquellos con TMB relativamente más alta y NLR más bajo también mejoran la supervivencia que aquellos que albergan TMB más baja y NLR más alto (SG mediana: 12,53 meses frente a 7,30 meses; P = 0,034), como se muestra en la Fig. 2.
Figura 2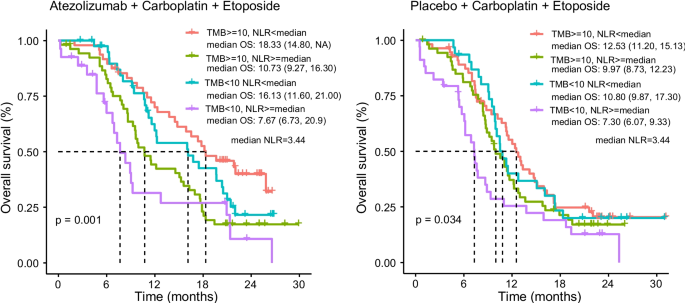
Papel de la combinación de TMB y NLR en la predicción de la supervivencia de pacientes con CPCP tratados con atezolizumab o quimioterapia estándar. Estimaciones de supervivencia de Kaplan-Meier para la SG según las diferentes combinaciones de TMB y NLR. (A) Cohorte de atezolizumab: TMB ≥ 10 mut/Mb y NLR < mediana frente a TMB ≥ 10 mut/Mb y NLR ≥ mediana frente a TMB < 10 mut/Mb y NLR < mediana frente a TMB < 10 mut/Mb y...