Abstracto
La lesión pulmonar aguda/síndrome de dificultad respiratoria aguda (ALI/ARDS) es un trastorno respiratorio devastador con altas tasas de mortalidad y morbilidad, pero los mecanismos subyacentes detallados de ALI/ARDS siguen siendo en gran parte desconocidos. Los canales de iones mecanosensibles (MSC), incluidos los canales de sodio epiteliales (ENaC), los canales piezoeléctricos, los canales de potencial receptor transitorio (TRP) y los canales de iones de potasio (K2P) de dominio de dos poros, se expresan altamente en los tejidos pulmonares, y la actividad de estos Las MSC pueden ser moduladas por fuerzas mecánicas (p. ej., ventilación mecánica) y otros estímulos (p. ej., LPS, hiperoxia). La disfunción de las MSC se ha encontrado en varios tipos de ALI/ARDS, y las MSC desempeñan un papel clave en la regulación de la eliminación de líquido alveolar, la función de barrera epitelial/endotelial alveolar, la respuesta inflamatoria y la secreción de surfactante en los pulmones ALI/ARDS. Dirigirse a las MSC ejerce efectos terapéuticos en el tratamiento de ALI/ARDS. En esta revisión, resumimos la estructura y las funciones de varias MSC bien reconocidas, el papel de las MSC en la patogenia de ALI/ARDS y los avances recientes en la modulación farmacológica y molecular de las MSC en el tratamiento de ALI/ARDS. De acuerdo con la literatura actual, apuntar a las MSC podría ser un enfoque terapéutico muy prometedor contra ALI/ARDS.
Introducción
La lesión pulmonar aguda (ALI) y su forma más grave, el síndrome de dificultad respiratoria aguda (SDRA), son trastornos respiratorios devastadores con altas tasas de morbilidad y mortalidad. [1,2,3]. ALI/ARDS es una consecuencia de causas no infecciosas (p. ej., dilatación del ventilador pulmonar, traumatismo y hemorragia) e infecciosas (p. ej., sepsis, neumonía, infección viral y pancreatitis) [2,3,4,5]. La patogénesis de ALI/ARDS es compleja; se caracteriza por la interrupción de la barrera del tabique alveolar y la inflamación grave dentro del pulmón, lo que da como resultado una inundación alveolar en parches, un flujo de entrada excesivo de células inmunitarias (neutrófilos y macrófagos), liberación de citocinas inflamatorias, síntesis alterada de surfactante e hipoxemia significativa. [1, 3]. Los tratamientos disponibles para ALI/ARDS son limitados e incluyen ventilación mecánica (MV) y suplementos de oxígeno (hiperoxia: HO) [1, 6]. Desafortunadamente, la VM inapropiada (p. ej., ventilación con volumen tidal alto) o la HO pueden inducir y agravar la lesión pulmonar. [1, 7,8,9]. Por lo tanto, comprender los mecanismos patológicos de ALI/ARDS y sus impulsores moleculares es crucial para el desarrollo de nuevas estrategias terapéuticas para ALI/ARDS.
La mecanosensación del entorno es un determinante importante del destino celular, que es necesaria para que los organismos vivos reciban y conviertan perturbaciones mecánicas en señales electroquímicas (mecanotransducción) [10, 11]. Numerosas moléculas, incluidos los canales iónicos, los citoesqueletos, las moléculas asociadas a la adhesión focal y los receptores acoplados a proteína G, median en el proceso de mecanosensación/mecanotransducción y la respuesta a las fuerzas mecánicas. [12,13,14,15,16,17,18]. Entre estas moléculas, se ha sugerido que los canales iónicos mecanosensibles (MSC) son los más importantes para mediar en el proceso de mecanosensación/mecanotransducción. En las últimas décadas, varios tipos de canales, incluida la familia de canales epiteliales de sodio/degenerina (ENaC/DEG), canales piezoeléctricos, superfamilia de potencial de receptor transitorio (TRP), canales de potasio de dominio de dos poros (K2P) y canales similares a transmembrana. 1/2 (TMC1/2) canales, han sido validados como MSC de buena fe [19,20,21,22,23]y se considera que la disfunción de estas MSC está involucrada en diversas afecciones y enfermedades patológicas (p. ej., dolor, cáncer, hipertensión pulmonar) [24,25,26].
Las células del parénquima pulmonar, las vías respiratorias y los sistemas vasculares bronquiales y pulmonares están continuamente sujetas a diversas fuerzas mecánicas (p. ej., esfuerzo cortante, estiramiento y presión hidrostática) asociadas con la inflación pulmonar, la perfusión vascular y la actividad física. [27, 28]. Las MSC (p. ej., la familia ENaC/DEG, los canales piezoeléctricos, la superfamilia TRP y los canales K2P) se expresan en los tejidos pulmonares (p. ej., células epiteliales, endoteliales e inmunitarias) [29,30,31,32]. La evidencia acumulada sugiere que las MSC juegan un papel crucial en la patogénesis de ALI/ARDS. Las MSC no se activan exclusivamente por fuerzas mecánicas (p. ej., estiramiento mecánico y esfuerzo cortante), sino que también están moduladas por una variedad de otros estímulos que se alteran en los pulmones ALI/ARDS, incluidos cambios en el pH o la temperatura, citoquinas inflamatorias (p. ej., TNF- α), fármacos (p. ej., anestésicos volátiles), ligandos biológicos (p. ej., ATP y lípidos) y cambios en el potencial de membrana (dependencia de voltaje) [29, 33, 34]. Amplios estudios han informado que la expresión y/o la actividad de estas MSC están alteradas en los pulmones ALI/ARDS [34,35,36]. También se ha sugerido que las MSC desempeñan un papel crucial en la ventilación mecánica, la hiperoxia y la señalización mediada por infecciones y citocinas durante la activación de células epiteliales, endoteliales e inmunitarias en los pulmones ALI/ARDS [7, 32, 37].
En esta revisión, nos enfocamos en la estructura y funciones de varias MSC reconocidas, resumimos las funciones de las MSC en la patogénesis de ALI/ARDS y describimos avances recientes en la modulación farmacológica y molecular de MSC en el tratamiento de ALI/ARDS. Sin duda, la combinación de nuestro conocimiento unificará estos campos y, en conjunto, los hallazgos sugieren que dirigirse a las MSC es un nuevo enfoque terapéutico muy prometedor contra ALI/ARDS.
Transducción de fuerza y mecanismos de activación de MSC
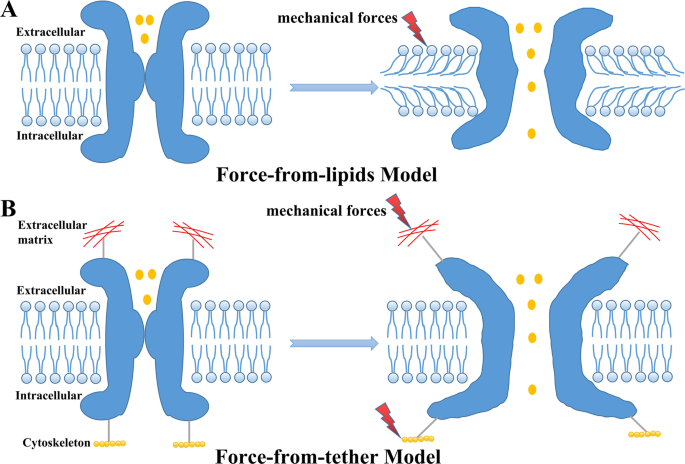
Una pregunta central se refiere a cómo las fuerzas mecánicas en los tejidos pulmonares se transducen a las MSC de puerta. A diferencia de otras moléculas, las MSC pueden responder rápidamente a las fuerzas mecánicas en milisegundos y convertir los estímulos físicos en señales electroquímicas. [22, 38]. Como se ilustra en la Fig. 1, se han propuesto dos modelos clásicos de mecanización para explicar cómo las fuerzas mecánicas pueden activar las MSC: (1) el “modelo de fuerza de los lípidos” propone que las fuerzas mecánicas aplicadas a la bicapa lipídica pueden activar directamente las MSC sin la necesidad de elementos adicionales como el citoesqueleto o proteínas accesorias; y (2) el “modelo de fuerza de ataduras” propone que las MSC están atadas a la matriz extracelular (ECM) y/o al citoesqueleto, y la transmisión de fuerzas mecánicas a través de una atadura que conecta las MSC puede cambiar la conformación de las MSC y la puerta estos canales [17, 22, 39, 40]. Hasta donde sabemos, se ha informado que los canales piezoeléctricos y varios canales K2P utilizan los modelos de fuerza de los lípidos para detectar perturbaciones mecánicas en una célula. [20, 22, 41]. Se ha demostrado elegantemente que los canales ENaC y los canales TRP interactúan con ECM o microtúbulos en un modelo de compuerta atado [19, 21]. Por lo tanto, las fuerzas mecánicas en los tejidos pulmonares se transmiten directamente a las MSC de puerta a través de la bicapa lipídica o se transmiten indirectamente a las MSC de puerta a través de ataduras (p. ej., citoesqueleto o ECM) [19, 29, 38]y las alteraciones en las propiedades mecánicas de los tejidos pulmonares ALI/ARDS, incluida la remodelación del citoesqueleto y la rigidez de la ECM, también pueden influir en la mecanotransducción mediada por MSC [42, 43].
Modelos mecanicistas de canales iónicos mecanosensibles (MSC). A Modelo de fuerza de lípidos. Las fuerzas mecánicas aplicadas a una bicapa de lípidos pueden activar directamente las MSC sin necesidad de elementos adicionales como citoesqueleto o proteínas accesorias. B Modelo de fuerza de ataduras. Las MSC están unidas a la matriz extracelular (ECM) y/o al citoesqueleto, y la transmisión de fuerzas mecánicas a través de una atadura que conecta las MSC puede cambiar la conformación de las MSC y abrir estos canales.
Mecanotransducción desregulada en ALI/ARDS
El pulmón es un órgano inherentemente mecanosensorial. Durante la respiración espontánea y la ventilación mecánica, los tejidos pulmonares están sujetos a diversas fuerzas mecánicas en forma de esfuerzo cortante, estiramiento cíclico, presión hidrostática, tensión/compresión o diversos grados de rigidez de la MEC. [27, 44]. Las MSC expresadas en tejidos pulmonares pueden ser activadas por…