Resumen
Antecedentes
La neumonía adquirida en la comunidad (NAC) se asocia con una alta morbilidad y tasa de hospitalización. En las enfermedades infecciosas, la genética del huésped desempeña un papel fundamental en la susceptibilidad y la respuesta inmunitaria, y las vías inmunitarias implicadas dependen en gran medida del microorganismo y su ruta de infección. Aquí nuestro objetivo fue identificar loci de riesgo genético para CAP mediante un estudio de asociación de genoma completo (GWAS) de casos y controles.
Métodos
Realizamos un GWAS en 3.765 individuos españoles, incluidos 257 pacientes adultos hospitalizados con NAC y 3.508 controles de población. La NAC neumocócica se documentó en el 30% de los pacientes; el 70% restante se seleccionó entre pacientes con etiología microbiológica no identificada. Probamos 7,6 millones de genotipos imputados mediante regresiones logísticas. Para la validación de los resultados se utilizaron GWAS del Biobanco del Reino Unido de neumonía bacteriana. Posteriormente, priorizamos genes y probables variantes causales según el mapeo fino bayesiano y la evidencia funcional. También se realizó la imputación y asociación de alelos HLA clásicos y aminoácidos.
Resultados
Seis variantes centinela independientes alcanzaron significancia para todo el genoma (p <5 × 10-8), tres en el cromosoma 6p21.32 y una para cada uno de los cromosomas 4q28.2, 11p12 y 20q11.22. Sólo una variante en 6p21.32 fue validada en GWAS independiente de neumonía bacteriana y neumocócica. Nuestros análisis priorizaron C4orf33 en 4q28.2, TAPBP en 6p21.32 y ZNF341 en 20q11.22. Curiosamente, los defectos genéticos de TAPBP y ZNF341 son errores innatos de inmunidad previamente conocidos que predisponen a la neumonía bacteriana, incluidos el neumococo y el Haemophilus influenzae. Todas las asociaciones no fueron significativas para los alelos HLA clásicos.
Conclusiones
Completamos un GWAS de CAP e identificamos cuatro nuevos loci de riesgo involucrados en la susceptibilidad a CAP.
Introducción
Las infecciones son una de las principales causas de muerte a nivel mundial y casi una de cada ocho muertes sigue debiéndose a infecciones bacterianas (1). La neumonía adquirida en la comunidad (NAC) se considera un importante problema de salud pública debido a su alta morbilidad y mortalidad (2, 3). La incidencia anual de NAC varía ampliamente en todo el mundo, con estimaciones entre 11 y 169 casos por 10.000 personas. El dato disponible para adultos en España es de 46,3 casos por 10.000 habitantes (4). Las complicaciones más comunes de la NAC son la sepsis o insuficiencia respiratoria grave, y la mortalidad por NAC se asocia mayoritariamente a pacientes hospitalizados, alcanzando el 23% en unidades de cuidados intensivos (UCI) (4, 5).
La genética del huésped juega un papel central en la respuesta a los patógenos y contribuye a explicar las diferencias en susceptibilidad y gravedad entre los pacientes.6,7,8). Específicamente, las evaluaciones de heredabilidad basadas en el polimorfismo de un solo nucleótido (SNP) en la neumonía respaldan que los factores genéticos del huésped explican una mayor proporción de la gravedad que de la susceptibilidad.7). Sin embargo, hay escasez de estudios genéticos destinados a identificar los factores genéticos implicados en la susceptibilidad o el pronóstico de la NAC. Además, la mayoría de ellos se han centrado en genes candidatos, especialmente en genes implicados en la respuesta inmune como los que codifican MBL, SFTPA1, SFTPA2, SFTPD, IL6 e IL10, entre otros (9, 10). Algunos otros estudios se han basado en estudios de asociación de todo el genoma (GWAS) para revelar loci de susceptibilidad a la neumonía en el antígeno leucocitario humano (HLA), MUC5AC, IL6R y TNFRSF1A (11, 12), y loci de gravedad de la neumonía en CFTR, R3HCC1L y HBB (7). Sin embargo, hay que señalar que estos estudios no han distinguido la fuente de infección, lo que implica que los pacientes son una mezcla heterogénea de pacientes con NAC y con infecciones nosocomiales, es decir, con neumonía adquirida en el hospital (NHA).
La NAC suele ser causada por varias bacterias, incluidas Streptococcus pneumoniae y Haemophilus influenzae, o virus (13, 14). S. pneumoniae es una de las principales causas de NAC y se ha identificado en aproximadamente un tercio de los casos hospitalizados en Europa, aunque estas frecuencias pueden estar subestimadas (13,14,15,16). La respuesta inmune varía ampliamente según el patógeno causante. Los errores congénitos de la inmunidad (IEI, normalmente denominados inmunodeficiencias primarias) respaldan firmemente que la predisposición a la infección por diferentes microorganismos suele depender de diferentes componentes del sistema inmunológico. Por ejemplo, los IEI que alteran la inmunidad mediada por interferón tipo I predisponen a la susceptibilidad a la neumonía grave por SARS-CoV-2 o los virus de la influenza, mientras que los IEI que predisponen a la infección neumocócica están particularmente involucrados en la opsonización o fagocitosis de bacterias opsonizadas por macrófagos esplénicos.6, 17, 18). Por lo tanto, los estudios destinados a identificar las bases genéticas de la susceptibilidad o la gravedad de las infecciones pueden beneficiarse de una homogeneización precisa de la fuente de infección y el microorganismo causante.
Para identificar variantes genéticas asociadas a NAC, aquí hemos realizado un GWAS de pacientes hospitalizados con diagnóstico único de NAC, centrándonos en pacientes con infección neumocócica o sin microorganismo causal identificado.
Materiales y métodos
Diseño del estudio
Realizamos un GWAS de casos y controles de una etapa de sujetos adultos de ascendencia europea de España (Fig. 1). No se realizó ningún cálculo estadístico para determinar el tamaño de muestra adecuado antes de realizar el estudio. Se reclutó a un total de 259 pacientes adultos hospitalizados con diagnóstico de NAC entre marzo de 2001 y 2016 de seis hospitales españoles y constituyeron los casos. Estos pacientes fueron incluidos en estudios previos de asociación de genes candidatos de CAP (9, 19). Se supone que los neumococos causan la mayoría de los casos de NAC en los que se encontraron resultados negativos utilizando métodos microbiológicos convencionales (14, 16, 20). Por lo tanto, para mantener homogéneo el microorganismo causante de la NAC, solo incluimos pacientes con infección neumocócica confirmada o aquellos en quienes no se identificó ningún microorganismo causante identificado. Los criterios de inclusión del estudio y las descripciones de fenotipo están disponibles en el material complementario.
Como controles se utilizaron los datos genéticos disponibles de 3.526 donantes del Biobanco de ADN de España (https://www.bancoadn.org), recolectados del Servicio Nacional de Sangre y han sido utilizados en un GWAS previo de COVID-19 grave (21). Todos los participantes de control eran adultos no relacionados y clínicamente no caracterizados. Refirieron ser de origen español y no tener antecedentes personales o familiares de enfermedades, tales como infecciosas, cancerosas, circulatorias, endocrinas, mentales o conductuales, nerviosas, visuales, auditivas, respiratorias e inmunológicas, entre otras.
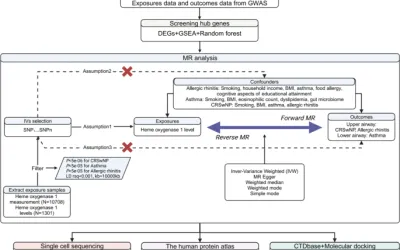
Figura 1Diagrama de flujo del diseño del estudio. CADD: Agotamiento dependiente de la anotación combinada, CAP: Neumonía adquirida en la comunidad, GWAS: Estudio de asociación de todo el genoma, HLA: Antígeno leucocitario humano, HRC: Consorcio de referencia de haplotipos, HWE: Equilibrio de Hardy-Weinberg, MAF: Frecuencia de alelos menores, MSC: Mutación Corte de significancia, QC: controles de calidad, V2G: variante del gen, VEP: predictor del efecto de la variante. Códigos de fenotipo del Biobanco del Reino Unido: neumonía bacteriana (480.1), neumonía neumocócica (480.11), neumonía por Pseudomonas (480.12), neumonía viral (480.2) y (480.3) neumonía debida a hongos (micosis).
Imagen a tamaño completoGenotipado, control de calidad e imputación de variantes.
Tanto los casos como los controles fueron genotipados con el Axiom Spain Biobank Array (Thermo Fisher Scientific) siguiendo las instrucciones del fabricante en el Nodo de Santiago de Compostela del Centro Nacional de Genotipado (CeGen-ISCIII; http://www.usc.es/cegen). El control de calidad del genotipado y los procedimientos de imputación de variantes se detallan en el material complementario. Realizamos un análisis de componentes principales (PC) (PCA) para derivar los PC principales para ajustes del modelo e identificar valores atípicos genéticos (Figura T1). Estos procedimientos nos dejaron con un total de 603.603 variantes genéticas para 257 pacientes hospitalizados con CAP y 3.508 controles.
Análisis estadístico y evaluación funcional de loci asociados.
Prueba de asociación de variantes
Para probar la asociación de variantes genéticas con CAP, utilizamos modelos de regresión logística aditiva en todas las variantes imputadas que satisfacen una buena calidad de imputación (Rsq ≥ 0,3) y un MAF ≥ 1% usando EPACTS v.3.2.6 (22). El modelo de asociación se ajustó por sexo y las primeras 3 PC y los resultados se evaluaron utilizando el factor de inflación genómica (λ) calculado con el paquete de brecha para R. Las asociaciones variantes se consideraron estadísticamente significativas en un umbral p <5,0 × 10-8. Las variantes centinela independientes se identificaron como aquellas que superaban p < 5,0 × 10-8 y mostraban un desequilibrio de ligamiento débil (LD; r2 <0,1) con otras en cada locus después aglomeración en PLINK. El pseudo-R2 de Nagelkerke se calculó basándose en un modelo de puntuaciones de riesgo poligénico (PRS) para determinar la cantidad de varianza explicada por las variantes centinela. El poder del estudio para detectar las variantes estadísticamente asociadas se evaluó ad hoc. La información detallada está disponible en el material complementario.
Se realizó un análisis de sensibilidad de las variantes centinela incluyendo otras covariables en el modelo de regresión logística (p. ej., edad), la etiología de la NAC, excluyendo los valores atípicos genéticos basados en la PCA y también probando su asociación con otros dos resultados de neumonía grave registrados. en la serie de casos por separado y combinado: (i) sepsis grave o shock séptico según los criterios disponibles en el momento del inicio del reclutamiento (23); y (ii) insuficiencia respiratoria grave, definida como una saturación de oxígeno <90% en aire ambiente, o una presión parcial de oxígeno (PaO2) <60 mmHg.
Dado que faltan GWAS independientes de CAP que puedan servir como una replicación formal de los hallazgos, accedemos al resumen disponible públicamente de GWAS de neumonía de origen infeccioso, bacteriano, fúngico y viral de los datos del Biobanco del Reino Unido (UKBB) (24) para validar la asociación de las variantes centinela independientes. Consideramos que los resultados estaban validados si la variante en el UKBB mostraba…