Resumen
Antecedentes
La transformación de las células del músculo liso de las vías respiratorias (ASMC) de un fenotipo inactivo a un fenotipo hipersecretor e hipercontráctil es una característica definitoria de la remodelación de las vías respiratorias asmáticas. La fisetina, un compuesto flavonoide, posee características antiinflamatorias en el asma; sin embargo, no se ha investigado su impacto en la remodelación de las vías respiratorias y la transición del fenotipo de las ASMC.
Objetivos
Esta investigación buscó evaluar el impacto de la fisetina en la remodelación de las vías respiratorias asmáticas inducida por la ovoalbúmina (OVA) y la transición del fenotipo de las ASMC, y aclarar los mecanismos a través de predicciones farmacológicas en red, así como validación in vivo e in vitro.
Métodos
En primer lugar, se construyó una red de fisetina-asma-ASMC para identificar objetivos potenciales. Posteriormente, se llevaron a cabo estudios celulares y en animales para examinar los efectos inhibidores de la fisetina en la remodelación de las vías respiratorias en ratones asmáticos y para determinar cómo la fisetina afecta la transición fenotípica de las ASMC.
Resultados
El análisis de la red indicó que la fisetina podría afectar el asma al mediar en la vía de la fosfatidilinositol 3-quinasa (PI3K)/proteína quinasa B (AKT). La administración intraperitoneal de fisetina in vivo redujo la inflamación y remodelación de las vías respiratorias, como lo demuestra la reducción de las células inflamatorias, la disminución de la liberación de citoquinas T auxiliares tipo 2 (Th2), la disminución de la acumulación de colágeno, el engrosamiento mitigado del músculo liso de las vías respiratorias y la disminución de la expresión de osteopontina (OPN), colágeno. -I y α-actina del músculo liso (α-SMA). Además, la fisetina suprimió la vía PI3K/AKT en el tejido pulmonar asmático. Según los datos in vitro, la fisetina reguló negativamente la expresión de las proteínas fenotípicas sintéticas OPN y colágeno-I, la proteína contráctil α-SMA, e inhibió la migración celular, potencialmente a través de la vía PI3K/AKT.
Conclusión
Estos resultados sugieren que la fisetina inhibe la remodelación de las vías respiratorias en el asma al regular el cambio fenotípico de las ASMC, lo que enfatiza que la fisetina es un candidato prometedor para el tratamiento de la remodelación del músculo liso de las vías respiratorias.
Fondo
El asma es una enfermedad multifacética y duradera con características patológicas como la inflamación y remodelación de las vías respiratorias. La remodelación de las vías respiratorias implica fibrosis subepitelial, aumento del volumen del músculo liso y agregación de la matriz extracelular.1). La remodelación estructural de las vías respiratorias causa estenosis de las vías respiratorias, restricción del flujo de aire y disminución de la función pulmonar, y afecta gravemente la calidad de vida.2). Los glucocorticoides se utilizan ampliamente como medicamentos de primera línea para el asma, pero se asocian con una variedad de reacciones adversas a los medicamentos, que incluyen síntomas psiquiátricos, retraso del crecimiento, anomalías de los dientes y erupciones cutáneas.3). Por lo tanto, se necesitan con urgencia agentes antiasmáticos novedosos y afectivos.
Las células del músculo liso de las vías respiratorias (ASMC) deterioradas desempeñan un papel importante en la remodelación estructural de las vías respiratorias. Las proteínas de la matriz extracelular y los factores de crecimiento transformantes promueven el cambio de las ASMC de una etapa latente a una sintética in vitro (4, 5). Las ASMC de pacientes asmáticos exhiben una preferencia por un fenotipo sintético en comparación con las de donantes no asmáticos (6). Las ASMC con un fenotipo sintético muestran características como hipertrofia, migración, proliferación y parasecreción, lo que conduce a un aumento de la tensión de las vías respiratorias, un empeoramiento de la mecánica y una hiperreactividad de las vías respiratorias exacerbada.7). Además, las ASMC contribuyen a la estenosis de las vías respiratorias y a la hiperreactividad de las vías respiratorias al modular la contractilidad celular (8). La expresión de la proteína contráctil α-actina del músculo liso (α-SMA) en las vías respiratorias está relacionada con la función de las vías respiratorias en el asma.9). Por tanto, es esencial desarrollar tratamientos dirigidos a la disfunción de las ASMC.
El compuesto 3,3′,4′,7-tetrahidroxiflavona (fisetina) es un flavonoide bioactivo natural ampliamente derivado de fuentes frutales y vegetales (10). La fisetina tiene numerosas funciones biológicas, que incluyen propiedades antienvejecimiento, anticancerígenas, antiinflamatorias y antifibróticas (11,12,13,14). Investigaciones anteriores revelaron que la fisetina suprime la inflamación de las vías respiratorias en un modelo de asma (15, 16). Se sabe que la fisetina tiene efectos potentes en una variedad de tipos de células de las vías respiratorias. La fisetina inhibe la infiltración de neutrófilos y macrófagos inducida por lipopolisacáridos y atenúa la lesión pulmonar aguda.17). La fisetina inhibe significativamente los niveles de interleucina (IL)-8 inducidos por el factor de necrosis tumoral alfa en las células epiteliales de las vías respiratorias humanas, lo que sugiere que la fisetina es un agente potencial para el tratamiento de enfermedades inflamatorias pulmonares.18). La fisetina tiene la capacidad potencial de inhibir la transición epitelial-mesenquimatosa inducida por el extracto de humo de cigarrillo en las células epiteliales de las vías respiratorias.19). Sin embargo, aún se desconoce su papel en la regulación de la remodelación de las vías respiratorias y la función de las ASMC.
En este documento, nuestro estudio se centró en los impactos de la fisetina en un modelo murino de asma. Se examinaron el cambio fenotípico y las funciones biológicas de las ASMC para dilucidar los mecanismos potenciales.
Materiales y métodos
reactivos
La fisetina se obtuvo de Beyotime (Shanghai, China). La ovoalbúmina (OVA) se adquirió de Sigma-Aldrich (Taufkirchen, Alemania). Los anticuerpos contra β-actina, GAPDH, fosfoinositida 3-quinasa (PI3K), p-PI3K y el inhibidor de PI3K LY294002 se obtuvieron de Beyotime (Shanghai, China). Los anticuerpos contra la proteína quinasa B (AKT), p-AKT, colágeno-I, osteopontina (OPN) y α-SMA se adquirieron de Cell Signaling Technology (Beverly, EE. UU.).
animales
Gem Pharmatech Company (Nanjing, China) proporcionó ratones hembra BALB / c (de 6 semanas de edad, con un peso de 18 a 20 g) y los mantuvo en condiciones estándar de laboratorio (22 a 24 ° C, 49 a 51% de humedad). El agua y la comida estaban disponibles gratuitamente para todos los animales. Todos los estudios con animales se realizaron siguiendo las pautas de los Institutos Nacionales de Salud (NIH) y fueron autorizados de acuerdo con el Comité de Ética del Segundo Hospital Afiliado de la Primera Universidad Médica de Shandong.
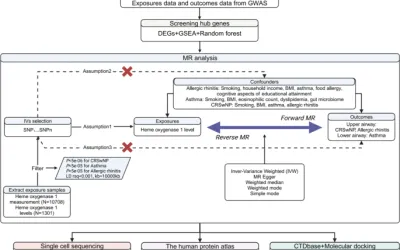
Farmacología en red
La estructura del sistema de entrada de línea de entrada molecular simplificado (SMILES) para fisetina se recuperó del sitio web de PubChem. El formato del archivo de fecha de estructura (SDF) se envió a la base de datos de predicción de Swiss Target (http://www.swisstargetprediction.ch/) para facilitar una mayor predicción de orientación (20). Los objetivos relacionados con el asma y ASMC se obtuvieron de GeneCards (https://www.genecards.org/) y bases de datos de herencia mendeliana en línea en el hombre (OMIM) (https://omim.org/) (21, 22). Los genes superpuestos relacionados con la fisetina, el asma y el ASMC se consideraron potencialmente valiosos para el tratamiento del asma. Metascape se implementó para realizar análisis de enriquecimiento funcional de genes (https://metascape.org/) (23). Se crearon y analizaron redes de interacción proteína-proteína (PPI) para clasificar genes centrales mediante la herramienta de búsqueda para la recuperación de genes/proteínas de interacción (STRING) (https://string-db.org/) (24). El análisis topológico y la visualización se realizaron utilizando el complemento Cytoscape NetworkAnalyzer.
Establecimiento del modelo asmático y tratamiento con fisetina.
Los ratones fueron asignados aleatoriamente a los siguientes cinco grupos (n = 10 por grupo): (1) grupo de control, (2) grupo de OVA, sensibilizado a OVA/expuesto a OVA; (3) grupo OVA + FL, sensibilizado a OVA/expuesto a OVA + dosis baja de fisetina (2,5 mg/kg); (4) grupo OVA + FH, sensibilizado a OVA/expuesto a OVA + dosis alta de fisetina (5 mg/kg); (5) Grupo OVA + DEX, sensibilizado a OVA/expuesto a OVA + 1 mg/kg de dexametasona. A los ratones se les administraron 100 µL de OVA mezclado con 2 mg de hidróxido de aluminio por vía intraperitoneal los días 1 y 8. Durante los días 15 a 43, los animales fueron nebulizados usando OVA al 2,5% durante 30 min/día, y luego se les administró tres veces por semana durante 4 semanas usando un nebulizador ultrasónico. Los grupos tratados con fármacos recibieron fisetina o dexametasona 30 minutos antes de cada exposición a OVA. Se utilizó dexametasona como control positivo porque es un tratamiento de primera línea establecido para el asma. Cifra 1 revela las estrategias experimentales.
Figura 1Estrategias experimentales y cronograma.
Imagen a tamaño completoExamen del líquido de lavado broncoalveolar (BALF)
Los animales fueron intubados por vía intratraqueal y se les administraron 750 µl de solución salina tres veces después de la eutanasia. El BALF se hizo girar a 2000 rpm y 4 ℃ durante 15 min. El sedimento se reconstituyó y se contó con un hemocitómetro. Los frotis se tiñeron con Giemsa y se examinaron bajo microscopía óptica. Los sobrenadantes de BALF se utilizaron para el análisis de citocinas. Los niveles de IL-4, IL-5 e IL-13 en BALF se midieron con paneles de ensayo inmunoabsorbente ligado a enzimas (ELISA). Se seleccionaron aleatoriamente cinco ratones de cada grupo para realizar recuentos celulares y análisis de citoquinas.
histopatología pulmonar
Las muestras de pulmón se incluyeron en parafina y se dividieron en cortes de 5 µm. Se empleó la tinción con hematoxilina y eosina (H&E) para evaluar los cambios patológicos pulmonares, mientras que la tinción de Masson se empleó para analizar el depósito de colágeno peribronquial. Se utilizó tinción con ácido periódico de Schiff (PAS) para examinar la hiperplasia de células caliciformes. Se utilizó el software Image-Pro Plus para cuantificar el área del músculo liso bronquial (WAm), el área teñida de Masson y el perímetro de la membrana basal bronquial (Pbm). Se realizaron análisis para determinar el grosor del músculo liso bronquial (WAm/Pbm), el área teñida con Masson/Pbm y el área teñida con PAS/Pbm. Las imágenes se fotografiaron bajo microscopía óptica con un aumento de 400 ×. Se seleccionaron aleatoriamente cinco ratones de cada grupo para el examen histológico y se cuantificaron cinco bronquiolos por ratón.
Inmunohistoquímica
Las muestras de parafina se desparafinaron, se rehidrataron, se sometieron a recuperación de antígenos y se bloquearon con suero. Posteriormente, las secciones se trataron con anticuerpos primarios dirigidos a colágeno I (1:200), OPN (1:100) y α-SMA (1:200) durante la noche a 4 ℃ y luego se expusieron a anticuerpos secundarios durante 1 h. Se aplicó DAB recién preparado para la detección cromogénica. Se obtuvieron fotografías de las secciones utilizando un microscopio óptico con un aumento de 400 ×. Se seleccionaron aleatoriamente cinco ratones de cada grupo para el análisis inmunohistoquímico y se cuantificaron cinco bronquiolos por ratón.
Cultivo celular
Las células del músculo liso de las vías respiratorias de ratón (MASMC) fueron…